George Huntington (1850-1916)
Определение и классификация
Хорея Гентингтона (Хантингтона) – тяжёлое наследственное прогрессирующее нейродегенеративное заболевание, ядром клинической картины которого являются экстрапирамидные и психические расстройства (рубрика G10 по МКБ-10).
Выделяют [3][6] четыре формы хореи Гентингтона (далее – ХГ):
- «Психическая» (продромальная).
- Гиперкинетическая или хореоатетоидная (классическая).
- Акинетико-ригидная (поздняя).
- Ювенильная (первичная акинетико-ригидная) (вариант Вестфаля).
Для количественной оценки степени выраженности функциональных нарушений при ХГ разработана универсальная оценочная шкала болезни Гентингтона (Unified Huntington Disease Rating Scale, UHDRS). Она представляет собой заполняемый исследователем балльный опросник, представленный несколькими секциями (двигательная сфера, когнитивные функции, поведение, функциональная активность и др.). Результаты опроса по каждой секции суммируются, что позволяет получить количественную оценку состояния пациента на данный момент, а также объективно проследить его в динамике [66].
Исторические сведения
Впервые симптомокомплекс ХГ, включая развитие деменции, был описан в работе норвежского врача Йохана Кристиана Лунда [43]. Однако работа скромного участкового врача не получила международной известности и была переведена на английский язык лишь в 1959г. В литературе иногда встречается эпонимическое название ХГ как «болезни Лунда – Гентингтона» [29].
Классической публикацией считается работа американского врача Джорджа Гентингтона [32], в которой он описал наблюдения над членами одной семьи, проживавшими в Лонг-Айленде. Разные поколения этой семьи наблюдались дедом и отцом Гентингтона, тоже врачами, на протяжении 75 лет. После Гентингтона наследственную прогрессирующую хорею описывали в разных странах. В 1885г. Перетти (Peretti) и в 1887г. Губер (Huber) предложили назвать заболевание «хореей Гентингтона» [1]. Более полную клиническую характеристику болезни Гентингтон дал в своей более поздней работе 1910 года [33].
Ювенильная форма ХГ была впервые описана немецким неврологом Иоганном Гоффманом в 1888 г. [51] на примере трёх поколений одной семьи, в которой две девочки заболели в возрасте 4 и 10 лет, причём картина заболевания проявлялась ригидностью, гипокинезией и судорогами. В литературе фигурирует эпонимическое название «форма Вестфаля» [2][6][58]; это связано с тем, что при острой мозжечковой атаксии Вестфаля – Лейдена финальная стадия зачастую неотличима от ХГ [75]. Вопрос о клиническом единстве острой мозжечковой атаксии и ювенильной формы ХГ остаётся спорным.
Пожалуй, одним из самых известных людей, страдавших ХГ, был американский фолк и кантри певец и композитор Вуди Гатри, Woody Guthrie (1912-1967), заболевший в 50-е годы (рис.1).
Рис.1. Американский певец и композитор Вуди Гатри(источник: http://www.historylink.org/db_images/woody.jpg)
Эпидемиология, этиология и патогенез
Распространённость ХГ составляет 4-10 на 100.000 населения, соотношение полов 1:1 [1][6][34]. Заболевание встречается во всех странах и у всех народностей. Наименьшая частота ХГ (менее 1 на 100.000) зарегистрирована среди коренных жителей Финляндии, Японии и негритянского населения Южной Африки и Северной Америки [51]. Самая высокая частота (более 17 на 100.000) зафиксирована в районе озера Маракайбо в Венесуэле, на островах Маврикий и Тасмания [58].
ХГ наследуется по аутосомно-доминантному типу с практически полной пенетрантностью мутантного гена, локализованного на коротком плече 4-й хромосомы (локус 4p16.3). Указанный ген (получивший название HD) был локализован в 1983г. [27] и идентифицирован в 1993г [67]. Он кодирует синтез уникального человеческого цитоплазматического белка гентингтина, функция которого до сих пор неизвестна; полагают, что он необходим для нормального эмбрионального развития [77] и нейрогенеза [73], а также кроветворения и сперматогенеза [40][49]. При ХГ повреждается кодирующая область гена HD в виде «экспансии тринуклеотидных повторов»: патологическом увеличении копий повторов ЦАГ (цитозин-аденин-гуанин). В норме имеется 6-35 таких повторов, при ХГ – от 36 до 120 и более, причём чем больше повторов, тем раньше начинается болезнь (феномен антиципации) и тем более тяжело она протекает. При количестве повторов 42 и более пенетрантность мутатного гена становится полной [12]. В процессе передачи дефектного гена от матери число повторов изменяется лишь на несколько, но при передаче от отца – существенно возрастает, напрямую коррелируя с возрастом отца («эффект отцовской передачи»). Предполагается, что дефектный ген наследуется от матери вместе с неизвестным пока экстрахромосомным фактором [21], существенно отдаляющим срок дебюта ХГ; существует и другая точка зрения на проблему разного возраста дебюта наследственных заболеваний при их передаче от матери или от отца: возможно, процессы метилирования повторяющихся фрагментов хромосом различаются в зависимости от пола, и эти различия («хромосомный импринтинг») могут служить причиной того, что ряд наследственных заболеваний протекает тяжелее и дебютирует раньше в зависимости от линии передачи [20] [57]. Среди таких заболеваний, кроме ХГ, находятся миотоническая дистрофия, нейрофиброматоз I типа (тяжелее протекают при наследовании по материнской линии), спиноцеребеллярная атаксия (раньше дебютирует при наследовании по отцовской линии) и нейрофиброматоз II типа (раньше дебютирует при наследовании по материнской линии). В последнее время появились работы, указывающие на наличие гена-модификатора возраста дебюта ХГ, расположенного в регионе 4p16 [19].
Клинический полиморфизм ХГ может проявляться даже в рамках одной семьи [14], что обусловлено в первую очередь различным числом повторов ЦАГ в мутантном гене у родителей и потомков. В литературе имеются сообщения о спорадических случаях ХГ, обусловленных, по-видимому, вновь возникшей мутацией [13][74]. Кроме того, было установлено, что ХГ является генетически гетерогенным заболеванием: например, описан случай гентингтоноподобного заболевания с интактным геном HD [64], при котором выявлена мутация гена «junctophiline-3» (44-летняя пациентка с подкорковой деменцией, мягкими хореическими гиперкинезами и атрофией коры головного мозга). В литературе имеются сообщения о генокопиях ХГ – при наличии классической клинической картины экспансии тринуклеотидных повторов в гене HD выявлено не было [8]. Возможны и специфичные для ХГ мутации, так и не проявляющиеся в виде ХГ клинически; так, в работе [71] была проведена ДНК-диагностика ХГ 368 пациентам с психическими расстройствами, в том числе, шизофренией, сенильной и пресенильной деменцией. У одного пациента, страдавшего шизофренией и умершего в 88-летнем возрасте, было обнаружено 36 ЦАГ-повторов, хотя клинических данных за ХГ не было.
Триплет ЦАГ кодирует аминокислоту глутамин, поэтому экспансия ЦАГ-повторов приводит к синтезу аномального гентингтина с существенно удлинённым полиглутаминовым участком. Этот участок вызывает формирование патологических межмолекулярных связей с рядом тканеспецифических белков ЦНС. Мутантный гентингтин подвергается протеолизу с участием проапоптозных ферментов – капсаз, инициирующих программируемую гибель нейронов, характерную для ХГ [55] [24]. Продукты распада аномального гентингтина скапливаются в нейротоксичные нерастворимые внутриклеточные включения, образованные низкомолекулярным белком убиквитином [18]. Убиквитин прикрепляется к другим белкам нейронов, что приводит к их последующему распаду. Продукты этих взаимодействий, в частности, эндогенный эксайтотоксин квинолиновая кислота (продукт обмена триптофана), считаются конечной причиной, вызывающей селективную гибель нейронов при ХГ, т.к. обладают наибольшей тропностью к клеткам мозга с высокой плотностью NMDA-рецепторов [4]. В головном мозге больных ХГ, особенно в стриатуме, показано повышение активности непосредственного биосинтетического фермента квинолата – 3-гидроксиантранилатоксигеназы (КФ 1.13.11.6) [61].
Определённую роль в патогенезе заболевания играет также выраженное снижение активности дыхательной цепи митохондрий в хвостатом ядре (скорлупе) [26] и нарушение митохондриального транспорта [28][52][68].
Патогенез психических расстройств при ХГ связан с нарушением функции ряда проводящих путей, участвующих в формировании систем на входе и выходе базальных гагнглиев [53]. Дорсолатерально-субкортикальная система проецирует дорсальную, переднюю и латеральную область префронтальной коры через дорсолатеральный участок головки хвостатого ядра на переднее вентральное и дорсомедиальное ядра таламуса. Она принимает участие в сложных познавательных процессах, включая кратковременную память, творчество и способность фиксировать заданную тему и переключаться с одной темы на другую. Повреждения в этой системе также затрагивают различные аспекты эмоционального и поведенческого контроля. Например, они могут нарушать нормальные проявления фрустрации, что приведёт к раздражительности и возбуждению. Орбитофронтальная система проецирует переднебоковую орбитофронтальную кору через вентромедиальный участок хвостатого ядра на те же (переднее вентральное и дорсомедиальное) ядра таламуса. Повреждения этой системы связаны с такими расстройствами, как депрессия и обсессивно-компульсивный синдром. Большинство клинических и научных исследований показали, что почти во всех случаях ХГ депрессия совпадала с дебютом расстройств моторики или возникала чуть позже; это говорит о том, что развитие депрессии при ХГ непосредственно связано с прогрессированием заболевания. Медиальная префронтальная система проецирует паралимбическую кору (заднемедиальную орбитофронтальную кору и переднюю часть поясной извилины) через nucleus accumbens на дорсомедиальное ядро таламуса. Она участвует в подавлении ответных реакций; при её дисфункции развивается апатия, встречаемость которой прямо пропорциональна продолжительности ХГ.
Замечено [42], что у пациентов с гипокинетическими расстройствами моторики чаще развиваются гипоактивные формы поведения, такие как апатия, в то время как для гиперкинетичных пациентов более характерны возбуждение, раздражительность и тревожность. Такие варианты поведенческих расстройств имеют под собой морфологическую основу, свидетельствуя, соответственно, о поражении медиальной префронтальной системы (при гипокинезии) и дорсолатерально-субкортикальной/орбитофронтальной систем (при гиперкинезах).
Патоморфология
На аутопсии макроскопически обнаруживается атрофия извилин, преимущественно лобных долей, и генерализованное симметричное расширение боковых желудочков, особенно передних рогов (рис.2).
Рис.2. Вид макропрепарата головного мозга при ХГ(источник:http://www.pharmacy.umaryland.edu/~gbuterba/HUNTINGTONS.jpg)
Микроскопически выявляется также атрофия стриатума (преобладает) и бледного шара. Исходная масса базальных ганглиев в наиболее тяжёлых случаях может снижаться более чем наполовину, а масса всего мозга – на 30-50% (рис.3.). Гибель нейронов и реактивный глиоз обнаруживаются также в таламусе, ретикулярной части чёрной субстанции, субталамическом ядре Люиса и коре больших полушарий [17][31]. Снижается плотность клеток Пуркинье в коре мозжечка и нейронов зубчатого ядра мозжечка. Иногда в патологический процесс может вовлекаться спинной мозг.
Рис.3. Атрофия базальных ганглиев при ХГ (на рисунке слева фронтальный разрез интактного головного мозга, справа – головного мозга больного ХГ; видна атрофия базальных ганглиев и вторичное расширение боковых желудочков) (источник: http://list-socrates.berkeley.edu/~jmp/HD.html)
Наиболее специфичным гистологическим изменением при ХГ является гибель шиповидных нейронов полосатого тела [70], что отмечается уже на самой ранней стадии болезни (рис. 4). Прогрессирование дегенерации происходит начиная с медиальных и дорсальных отделов хвостатого ядра по направлению к его латеральным и вентральным отделам; при этом вначале поражаются дорсолатерально-субкортикальная и орбитофронтальная системы проводящих путей, а затем – медиальная префронтальная (см. выше в разделе «Эпидемиология, этиология и патогенез») [53]. В тяжёлых случаях гибнет более 70% клеток стриатума. Шиповидные нейроны составляют около 95% клеток полосатого тела человека и секретируют разнообразные нейропептиды, в том числе энкефалины и субстанцию Р. От них же начинаются пути от полосатого тела к бледному шару и ретикулярной части чёрной субстанции. Выборочная уязвимость клеток уникальна для ХГ и не встречается более ни при одном из известных наследственно-дегенеративных заболеваний. Селективная гибель клеток наблюдается также и в коре большого мозга, где происходит истощение больших пирамидных нейронов в III, V и VI слоях при сохранности ГАМКергических нейронов местных циркулярных связей. В начальных стадиях болезни гибель клеток коры полушарий большого мозга частично компенсируется активным ветвлением дендритов выживших пирамидных клеток, что сохраняет нормальную метаболическую активность коры.
Рис.4. Гибель нейронов и глиоз в хвостатом ядре при ХГ(источник:http://medgen.genetics.utah.edu/photographs/diseases/high/cns239.jpg)
При электронной микроскопии выявляются характерные внутриядерные включения, представляющие собой высокомолекулярные амилоидоподобные агрегаты – результат «сшивок» продукта мутантного гена с окружающими полипептидными молекулами.
При ювенильной форме Вестфаля выявляются значительные разрушения скорлупы и коры больших полушарий. Выраженный глиоз бледного шара может протекать без утраты нейронов. У некоторых пациентов молодого возраста отмечается гиперпигментация чёрного вещества.
Клиническая картина
Гиперкинетическая форма
Эта форма ХГ встречается наиболее часто. Манифестирует в зрелом возрасте, обычно в 30-70 лет. Возникновению хореических гиперкинезов предшествует продромальная стадия нарушений психики длительностью до 10 лет: суетливость, повышенная возбудимость, двигательное беспокойство, ангедония, отчуждение, асоциальное поведение, апатия, обсессивно-компульсивные расстройства, депрессия. Окружающие и родственники замечают, что больной много жестикулирует, неусидчив. Постепенно снижаются когнитивные способности. Такой вариант развития ХГ, начинающийся с психических нарушений, встречается очень часто – до 79% случаев, причём он тем более вероятен, чем моложе пациент [53].
Таким образом, при ХГ существует многолетняя стадия «предболезни», связанная с постепенным нарастанием субклинических и биохимических изменений в веществе мозга. На этом фоне постепенно появляются типичные хореические гиперкинезы (следует заметить, что наряду с хореическими при ХГ могут встречаться миоклонические и тикозные гиперкинезы).
Весьма характерно, что больные поначалу не замечают у себя наличия гиперкинезов, считают их произвольными движениями и не говорят о них врачу. Возможен также феномен паракинезии – модификации непроизвольных движений самим пациентом в произвольные целенаправленные [58].
Вначале гиперкинезы имеют низкую амплитуду, наблюдаются в дистальных отделах конечностей («игра на пианино»), мимической мускулатуре, языке. Больные способны на короткое время подавлять насильственные движения. В дальнейшем гиперкинезы нарастают по амплитуде, становятся размашистыми, генерализованными и неконтролируемыми. Меняется походка («танцующая походка»), мимика (гримасничанье) – см. рис.5 –, жестикуляция, речь (дизартрия) и почерк. Характерно нарастание выраженности гиперкинезов, вплоть до кратковременной «двигательной бури», при волнении, интенсивной умственной деятельности, произвольных движениях и перемене положения тела. Некоторые авторы считают баллизм хореическим гиперкинезом максимальной выраженности [58]. Во сне гиперкинезы исчезают. По мере прогрессирования болезни из-за выраженных гиперкинезов больные теряют способность самостоятельно передвигаться и обслуживать себя. Из-за существенных энергетических затрат на насильственные движения больные могут значительно терять в массе тела.
Рис.5. Гиперкинезы мимических мышц у больной ХГ (источник: [1], стр. 289)
Мышечный тонус чаще нормален, реже отмечается гипотония мышц или пойкилотония («подвижный спазм»). Пассивные движения нередко вызывают длительные мышечные сокращения, которые больной не в состоянии преодолеть.
Слабость мышц встречается крайне редко, иногда сопровождаясь атрофией. Расстройств чувствительности и рефлексов не наблюдается (редко – повышение сухожильных рефлексов).
Больные ходят с широко расставленными ногами, шея вытянута вперёд, туловище несколько повёрнуто вокруг собственной оси. Если больной не пользуется компенсаторными приёмами для уменьшения гиперкинезов (например, не держится одной рукой за другую за спиной), то при ходьбе происходит разбрасывание рук, пританцовывание или внезапное выбрасывание ноги вперёд. Во время ходьбы больной может внезапно устремиться вперёд, спотыкаясь и волоча одну ногу по земле. Также внезапно может возникать тоническое напряжение мышц, приводящих бёдра, что придаёт своеобразную позу – больные идут со сведёнными бёдрами и коленями. Несмотря на существенные нарушения движений, больные редко падают, не наталкиваются на окружающие предметы, на время способны подавлять гиперкинез и совершать, хотя подчас и уродливо, нужное движение. Поэтому даже при выраженной хорее больные в состоянии самостоятельно одеваться, раздеваться и элементарно обслуживать себя. Тем не менее, если приступ гиперкинеза возникает, например, на лестнице, то больные иногда не могут сохранить равновесие, падают и получают травмы.
Очень характерное для ХГ участие в гиперкинезе артикуляционных мышц приводит к своеобразному расстройству речи: больные говорят с трудом, медленно, глухим голосом, речь прерывается сопением, всхрапыванием, отмечаются элементы дизартрии. Тем не менее, даже на поздних стадиях болезни речевой контакт остаётся возможным. Непроизвольные, «лишние» звуки возникают и когда больной молчит, из-за гиперкинезов языка, мягкого нёба, губ, диафрагмы, прямых мышц живота: больные сопят, всхрапывают, икают и издают другие, трудно сравнимые с чем-либо звуки. Отмечаются также непроизвольные глотательные движения. Хореоатетоз может наблюдаться в любых мышцах, кроме наружных мышц глаз, которые всегда остаются интактными.
Расстройства содружественных движений глаз встречаются уже на ранних стадиях ХГ и проявляются в невозможности слежения за медленно передвигающимся предметом (оно прерывается саккадическими движениями глаз), а также невозможности фиксировать взор на заданном предмете при появлении на периферии поля зрения другого предмета (возникают непроизвольные саккадические движения глазных яблок в сторону другого предмета) [58].
В отдельных семьях в первые годы болезни гиперкинез может ограничиваться мышцами только одной половины тела (гемихорея), или только плечами и руками, или головой и лицом.
Вместе с двигательными нарушениями постепенно начинает развиваться деменция подкоркового (подкорково-лобного) типа с замедлением когнитивных функций, ослаблением критики, апатией, депрессией, нередко – суицидальными попытками, снижением памяти (в меньшей степени). В то же время сохранено понимание и продукция речи, нет агнозии. По мере прогрессирования заболевания развивается тотальная деменция с распадом личности, на фоне которой могут наблюдаться аффективные, бредовые или галлюцинаторно-бредовые психозы. Развитие деменции обусловлено первичной дегенерацией хвостатого ядра и прерыванием волокон, идущих от префронтальной коры к хвостатому ядру. Следует заметить, что в отличие от подкорковой деменции, характерной для ХГ, корковая деменция манифестирует афазией, апраксией, агнозией и тяжёлой амнезией.
Довольно часто имеют место клинически выраженные вегетативные расстройства: акроцианоз, трофические нарушения. Весьма характерно существенное снижение массы тела. У некоторых больных изменяется аппетит, появляется жажда, булимия. Субклинические вегетативные нарушения (например, по данным кардиоинтервалографии) встречаются в 44% случаев уже на ранних стадиях ХГ [10].
В некоторых случаях при ХГ возникают своеобразные пароксизмальные состояния, особенно часто встречающиеся у молодых людей. Они разнообразны по своему характеру: головокружения, судорожные тонико-клонические припадки, внезапно возникающие приступы «подвижного спазма» и т.п. Эти приступы могут встречаться без явных признаков болезни, и тогда связать их с ХГ можно только при соответствующем семейном анамнезе.
Акинетико-ригидная форма
Характеризуется постепенным развитием экстрапирамидной ригидности и постуральной неустойчивости при длительном течении ХГ. Эта форма, являющаяся финалом болезни, составляет около 10% от общего числа больных ХГ. При ней нередко отмечаются контрактуры (в том числе за счёт дистоний), кахексия и тяжёлые вегетативно-трофические расстройства. Гиперкинезы постепенно сходят на нет, появляется спастичность, клонусы, патологические рефлексы.
Ювенильная форма Вестфаля
Эта форма имеет самостоятельное клиническое значение, являясь первичным акинетико-ригидным вариантом ХГ, и наблюдается в 5-10% случаев. Заболевание манифестирует до 20-летнего возраста, т.е., значительно раньше, чем в общей популяции пациентов с ХГ. В клинической картине у ребёнка преобладает мышечная ригидность, контрактуры, изменения поведения, нарушение умственного развития. Хореические гиперкинезы могут быть выражены незначительно, нередко ограничиваясь периоральной мускулатурой, языком и дистальными отделами рук, или же вообще отсутствовать. Впрочем, уже на начальных стадиях у ребёнка могут появляться непроизвольные движения, гримасы, жестикуляция, синдром гиперактивности; больной не способен длительно поддерживать одну позу и фиксировать взор на одном предмете. Возможны различные дистонии. Несмотря на оживление сухожильных рефлексов, параличи не развиваются. Может развиваться спастичность, редкая у взрослых. Иногда ведущими проявлениями заболевания становятся мозжечковые симптомы.
Своеобразным нарушением глазодвигательной функции являются ограничение подвижности глазных яблок и окуломоторная апраксия: при быстром переводе взора от одного предмета к другому возникает опускание век с быстрыми подёргивающими движениями головой и остановкой взора.
Судороги, редко развиваясь у взрослых с ХГ, у детей встречаются в 25-50% случаев. Заболевание может начинаться с абсансов, чаще атипичных, реже – с миоклонических судорог, в дальнейшем присоединяются вторично-генерализованные припадки.
Речь больных затруднена, сопровождается массой сопутствующих ненужных движений (шмыганье носом, причмокивание губами, цоканье языком, гримасы, вздохи). В финальной стадии развивается дисфагия, которая и бывает причиной аспирации и смерти больных.
ХГ у детей прогрессирует быстрее, чем у взрослых. Средняя продолжительность болезни у детей – 8 лет (у взрослых – 20). В течение всего этого времени у заболевших детей сохраняется инфантилизм. Чаще больные ювенильной формой ХГ наследуют заболевание по отцовской, нежели по материнской линии [11][69].
Разнообразие неврологических проявлений при варианте Вестфаля существенно затрудняет диагностику. Определённое диагностическое значение имеет фармакологическая нагрузка леводопой, при которой минимально выраженный хореиформный гиперкинез усиливается и становится явным.
Американскими врачами I.Shoulson и S.Fahn была предложена шкала для оценки дефицита функций при ХГ, которая в 2001г. была адаптирована для ювенильной формы [35].
A. Посещение школьных занятий
3 – посещает обычную школу без каких-либо специальных занятий;
2 – посещает обычную школу с частью занятий по специальной программе;
1 – посещает обычную школу, почти все (или все) занятия по специальной программе;
0 – не способен посещать школу или заниматься по специальным программам.
B. Навыки общения и обучения
3 – навыки письма/чтения/счёта соответствуют возрасту;
2 – снижение способности к обучению при сохранности письма и возможности тестирования;
1 – не может писать, но способен к устному общению;
0 – не может читать/писать/общаться устно.
С. Выполнение работы по дому
2 – способен помогать по дому соответственно возрасту;
1 – лишь изредка выполняет какую-либо работу по дому;
0 – не может выполнять работу по дому.
D. Навыки самообслуживания
3 – навыки самообслуживания соответствуют возрасту;
2 – нуждается в посторонней помощи, чтобы искупаться, одеться, привести себя в порядок, принять пищу;
1 – не может искупаться, одеться, принять пищу без посторонней помощи;
0 – совершенно не способен принять участия в своём обслуживании.
E. Проживание
2 – дома с членами семьи;
1 – дома/в спецобщежитии/в интернате посторонней помощью (не членов семьи);
0 – в специальном учреждении с профессиональным медицинским уходом.
Сумма баллов A-E характеризует стадию болезни:
- 11-13 баллов: I стадия;
- 7-10 баллов: II стадия;
- 3-6 баллов: III стадия;
- 1-2 балла: IV стадия;
- 0 баллов: V стадия.
«Психическая» (продромальная) форма
Иногда в клинической картине заболевания на протяжении длительного времени преобладают разнообразные психопатологические проявления, в то время как нарушения моторики остаются минимальными или отсутствуют в течение ряда лет. При таком варианте развития заболевания нередко ошибочно диагностируются пресенильная и сенильная деменции, шизофрения, реактивные психозы, а больные, как правило, становятся пациентами психиатрических стационаров.
Нередко возникают параноидно-галлюцинаторные психозы с очень яркими зрительными, тактильными, слуховыми галлюцинациями, бредом величия. При этом слуховые галлюцинации резче и ярче зрительных.
Дополнительные методы исследования
Лабораторные анализы при ХГ в целом остаются в пределах нормы. При специальном биохимическом анализе крови можно выявить снижение концентрации ГАМК, глутаматдекарбоксилазы, холин-ацетилтрансферазы [34]. При ликворологическом исследовании нередко отмечается повышение содержания белка.
Характерным и ранним ЭЭГ-признаком ХГ является депрессия альфа-ритма с преобладанием низкоамплитудной биоэлектрической активности мозга.
При КТ головного мозга у больных выявляется расширение боковых желудочков и субарахноидальных пространств (рис.6). В целом степень выраженности гидроцефалии коррелирует с тяжестью заболевания.
Рис.6. КТ пациента с ХГ: диффузная атрофия коры и избирательная атрофия хвостатых ядер, о которой можно судить по расширению боковых желудочков (источник: [34])
МРТ также выявляет общую атрофию головного мозга, при этом более чётко визуализируется атрофия головки хвостатого ядра и расширение передних рогов боковых желудочков. При злокачественной форме Вестфаля на МРТ в Т2-режиме можно увидеть очаги повышенной интенсивности сигнала в области стриатума. Однако изменения на томограммах могут носить неспецифический характер для любого нейродегенеративного процесса.
Высокоспецифичным нейровизуализационным признаком ХГ считается увеличение бикаудального диаметра (расстояния между головками правого и левого хвостатого ядра), выявляемое при КТ или МРТ [58].
Однофотонная эмиссионная компьютерная томография (ОФЭКТ, англ. – SPECT) является более чувствительным и специфичным методом диагностики ХГ: после инфузии радиоактивной фтордиоксиглюкозы выявляется уменьшение метаболизма глюкозы в хвостатых ядрах, причём иногда ещё на доклинической стадии болезни. Такие же изменения (рис.7) выявляются и при ПЭТ [30][47].
Рис.7. ПЭТ пациента с ХГ: стрелками указаны участки пониженного метаболизма глюкозы в области базальных ганглиев (источник: [46])
Наиболее совершенным методом диагностики ХГ, а также выявления пресимптомного носительства мутантного гена у клинически здоровых родственников, является ДНК-тестирование с исследованием тринуклеотидного ЦАГ-участка гена [6]. Чувствительность метода оценивается как 97,7-99,4%, специфичность – как 95,5-100% [39]. Обнаружение экспансии тринулеотидных повторов в гене (свыше 36 копий ЦАГ-триплетов) позволяет с абсолютной точностью подтвердить наличие мутации. Это особенно важно в атипичных и спорадических случаях ХГ, а также в практике медико-генетического консультирования при исследовании лиц из группы высокого риска.
Дифференциальная диагностика
ХГ следует дифференцировать с различными состояниями, при которых возникает расстройство двигательной сферы (в том числе в детском возрасте) и/или деменция.
• Ревматическая, или малая, хорея (хорея Сиденгама)
Начинается остро, вслед за перенесённым ОРЗ, связана со стрептококковой инфекцией и ревматизмом. Встречается чаще у девочек. В отличие от ХГ больные не могут произвольно подавлять гиперкинезы, которые являются политопными и носят быстрый и неритмичный характер, с наклонностью к застыванию в конце движения. При ХГ гиперкинезы возникают не так внезапно, по темпу более медленные, нередко с достаточно выраженным торсионным, судорожным компонентом; промежутки между насильственными движениями более длительные; по амплитуде движения не столь размашисты, так что больной меньше истощается, а в начальном периоде болезни может даже совершать несложную работу. Наблюдаются как гемиформы, так и генерализованные формы хореи Сиденгама. Выражена мышечная гипотония, сухожильные рефлексы снижены, пирамидные рефлексы отсутствуют. Характерны симптомы Гордона-II, Херсонского, Черни, «хореическая кисть» (с флексией пальцев, гиперэкстензией в метакарпальных суставах и приведением большого пальца). Заболевание сопровождается выраженными вегетативными реакциями и функциональными психическими нарушениями (аффективные реакции, тревожность и импульсивность, снижение памяти). В настоящее время малая хорея встречается редко; излечение в большинстве случаев спонтанное, следует лечить основное заболевание.
• Доброкачественная непрогрессирующая семейная хорея
Чрезвычайно редкое заболевание (описано лишь у нескольких десятков семей) с полигенным типом наследования, чаще аутосомно-доминантным с неполной пенетрантностью. Начинается в детском возрасте хореическим гиперкинезом туловища и головы в сочетании с атаксией и постуральным тремором. Нередко наблюдаются дизартрия и повышение сухожильных рефлексов с пирамидными симптомами. С годами выраженность гиперкинеза может уменьшаться, а другие поражения нервной системы – не появляться (в отличие от ХГ). Деменция никогда не развивается. Нейровизуализация не выявляет атрофии мозга, хотя при ОФЭКТ можно найти снижение метаболизма глюкозы в хвостатых ядрах.
• Нейроакантоцитоз, в том числе синдром HARP
Акантоцитоз характеризуется появлением в крови акантоцитов – эритроцитов с изменчивой формой и шиповидными выростами оболочки (от гречкеского acanth – рог), представляющих более 50% всех красных кровяных клеток. Такие изменённые эритроциты описаны у больных с дислипопротеинемиями и болезнью Галлервордена – Шпатца. Нейроакантоцитоз (синдром Ливайна – Критчли) – наследственное заболевание (OMIM *100500, 9q21, ген CHAC, аутосомно-доминантное наследование; OMIM 200150, аутосомно-рецессивное наследование), проявляющееся после полового созревания (как правило, на втором десятилетии жизни или позже).
Клиническая картина нейроакантоцитоза чрезвычайно полиморфна. Она проявляется в первую очередь прогрессирующим хореиформным гиперкинезом с частой локализацией в периоральной и другой мимической мускулатуре. У больных отмечается стереотипное гримасничанье, некоординированные движения языком и губами, вокализация (сопение, похрюкивание, икота и т.п.). Типично прикусывание языка и надкусывание слизистой оболочки рта, иногда представляющее серьёзную проблему и заставляющее пользоваться специальными прокладками. Речь дизартричная, прерывистая. В последующем отмечается неуклонная генерализация хореического гиперкинеза. В отличие от больных с ХГ, пациенты с нейроакантоцитозом гораздо лучше могут самопроизвольно контролировать выраженность гиперкинезов, особенно на ранней стадии болезни. Характерной особенностю нейроакантоцитоза является сочетание хореи с рядом других расстройств моторики – дистонией (особенно оромандибулярной), тиками, паркинсонизмом, атаксией, амиотрофиями, периферическими парезами конечностей. Возможны такие проявлеия, как угнетение или отсутствие рефлексов, генерализованные судороги (у 40% больных), аффективные расстройства, аутоагрессия, деменция.
Диагностика акантоцитоза основывается на выявлении акантоцитов (более 15%) в высушенных мазках крови или во влажном препарате с добавлением изотонического раствора хлорида натрия. При нейровизуализации отмечается атрофия хвостатых ядер с повышением сигнала от хвостатых и чечевицеобразных ядер на МРТ. На КТ видна неспецифическая церебральная атрофия. При ОФЭКТ можно наблюдать выраженное снижение активности дофаминовых D2-рецепторов. При ЭНМГ могут выявляться признаки аксональной полинейропатии. Уровень сывороточных липопротеинов при нейроакантоцитозе находится в пределах нормы. Нередко повышается уровень сывороточной КФК.
Продолжительность жизни при нейроакантоцитозе составляет в среднем 14 лет от момента появления первых симптомов.
При наличии гипобеталипопротеинемии, акантоцитоза, пигментного ретинита и паллидарной дегенерации говорят о синдроме HARP, который проявляется в первом десятилетии жизни и неврологически представлен дистонией, дизартрией, нарушением походки и вышеописанным симптомокомплексом нейроакантоцитоза.
Для него характерен дебют в возрасте до 21 года (чаще – до 18 лет). В основе клинической картины лежат тикозные гиперкинезы – множественные моторные в сочетании с с одним или несколькими вокальными. Зачастую наблюдается закономерная эволюция гиперкинезов, сопровождающаяся расширением локализации (лицо – шея – туловище – ноги) и усложнением его структуры (простые моторные – простые вокальные – сложные моторные и вокальные). Возможно наличие копролалии, эхолалии, копропраксии, эхопраксии и других сходных феноменов. Заболевание в целом имеет благоприятный прогноз: с возрастом интенсивность гиперкинезов, как правило, уменьшается. В литературе описаны случаи [38], когда синдром Туретта в последующем трансформировался в ХГ.
• Болезнь Галлервордена – Шпатца
Для неё характерен аутосомно-рецессивный тип наследования, наличие дистонии, пигментного ретинита, а также весьма специфичная МРТ-картина в виде «глаз тигра».
• Ригидная форма торсионной дистонии
Для неё характерен драматический эффект приёма малых доз препаратов леводопы, отсутствие изменений головного мозга по данным КТ/МРТ.
• Гепатоцеребральная дистрофия (болезнь Вильсона – Коновалова)
Для неё характерен аутосомно-рецессивный тип наследования, изменения обмена меди и наличие роговичного кольца Кайзера – Флейшера.
• Болезнь Паркинсона с ювенильным дебютом
Ювенильный паркинсонизм – особый синдром паркинсонизма, отличающийся семейным характером, своеобразием клинических проявлений (высокая чувствительность к препаратам леводопы, выраженные флуктуации двигательных функций на протяжении суток), морфологических изменений (прежде всего, отсутствием в дегенерирующих нейронах телец Леви). Это самостоятельная нозологическая форма с аутосомно-рецессивным (локус 6q25.2-q27 – ген, кодирующий белок паркин; и локус 1p35-36 – ген PARK6, отличается от паркин-ассоциированного ювенильного паркинсонизма более поздним началом (32-48 лет), более медленным течением и хорошим эффектом препаратов леводопы) или аутосомно-доминантным (локус 4p21-23 – ген, кодирующий белок альфа-синуклеин; и локус 2p13) типом наследования.
Дебют чаще всего приходится на 10-40 лет, реже – на более ранний возраст. У больных появляются скованность и болезненные спазмы в мышцах ног, вычурные движения в стопах, скованность и тремор в руках, меняется походка и почерк. Постепенно на протяжении ряда лет формируется отчётливый синдром паркинсонизма с олигобрадикинезией, мышечной ригидностью, гипомимией, пропульсией/ретропульсией, застываниями. Тремор имеет место лишь у 50% больных, чаще постуральный или кинетический. Паркинсонизм часто сочетается с дистониями (дистонические позы стоп и туловища, реже – кривошея, писчий спазм, дистония мышц глотки и гортани и др.), особенно при возникновении болезни в более раннем возрасте. Даже при многолетнем течении обычно отсутствует деменция и другие психические расстройства, а симптомы вегетативной дисфункции выражены минимально.
При КТ/МРТ головного мозга выявляется слабая или умеренная степень атрофии конвекситальных отделов коры больших полушарий (особенно в лобных отделах), среднего мозга и (реже) мозжечка, а также расширение III желудочка. При ОФЭКТ обнаруживается снижение перфузии в области базальных ганглиев.
• Липидозы
Болезнь Гоше (цереброзидный липидоз), тип 3 (церебральная форма взрослых) наследуется по аутосомно-рецессивному типу и проявляется гепатоспленомегалией, гиперспленизмом, поражением костей, судорожными припадками, атаксией, спастической параплегией, офтальмоплегией, деменцией.
Болезнь Ниманна – Пика (сфингомиелиновый липидоз), типы С, D, E наследуются по аутосомно-рецессивному типу, начинаются в дошкольном возрасте, смерть обычно наступает к 15-20 годам (течение при типах D и E более мягкое). Проявляется атаксией, атетозом, эпилептическими припадками, потерей предварительно освоенной речи, задержкой психомоторного развития, спастичностью, деменцией, гепатоспленомегалией, холестатической желтухой, нарушениями функций печени, обнаружением пенистых клеток в костном мозге.
Группа церебральных сфинголипидозов – наследственные заболевания со сходными клиническими формами, характеризующиеся мышечным гипертонусом, прогрессирующим спастическим параличом, потерей зрения (обычно с центральной дегенерацией сетчатки и атрофией зрительного нерва), судорогами и умственными дефектами. Сочетаются с аномальным отложением сфингомиелина и родственных липидов. Клинически и по срокам манифестации различают следующие формы: детская (болезнь Тея – Сакса), юношеские (болезни Янского – Бильшовского, Баттена -Шпильмейера – Фогта) и взрослую (болезнь Куфса).
• Синдром Леша – Найена
Редкое наследственное нарушение обмена (Х-сцепленное рецессивное наследование, дефект гена HPRT, локус Xq26-q27.2), связанное с абсолютной недостаточностью гипоксантин-гуанин-фосфорибозилтрансферазы (КФ 2.4.2.8). Проявляется только у мальчиков повышенной экскрецией мочевой кислоты и уратов, хореоатетозом, умственной отсталостью, спастическими парезами, приступами агрессивного поведения со склонностью к членовредительству. При частичной недостаточности фермента развивается острый подагрический артрит, нефролитиаз.
• Дентато-рубро-паллидо-льюисова атрофия (ДРПЛА)
Редкое наследственное нейродегенеративное заболевание, наиболее распространённое в Японии, где его частота составляет 0,2-0,7 на 100.000 населения [6]. Тип наследования – аутосомно-доминантный, с полной пенетрантностью мутантного гена, располагающегося на коротком плече 12-й хромосомы. Сущность болезни, как и при ХГ, заключается в экспансии тринуклеотидных повторов ЦАГ. Характерная особенность – крайне выраженный полиморфизм клинических проявлений, складывающихся из комбинации хореоатетоза, миоклоний, паркинсонизма, эпилептических припадков, атаксии и деменции.
В случае позднего начала ДРПЛА (после 40 лет) у больных обычно наблюдается фенотип «псевдохореи Гентингтона» с развитием хореического или хореоатетоидного гиперкинеза и деменции. При ювенильном варианте ДРПЛА (начало до 20 лет) обычно развивается наиболее злокачественный вариант болезни в виде быстро прогрессирующего синдрома миоклонус-эпилепсии. «Промежуточный» фенотип ДРПЛА характеризуется смешанной симптоматикой. Во всех возрастных группах весьма характерным проявлением болезни является мозжечковая атаксия, которая зачастую маскируется хореей и другими моторными нарушениями.
При МРТ выявляется расширение субарахноидальных пространств мозжечка и большого мозга, расширение IV, III и боковых желудочков, атрофия покрышки ствола. Помимо атрофических изменений, при исследовании в Т2-режиме обнаруживаются также диффузные симметричные зоны повышенного сигнала в белом веществе больших полушарий, реже – в области ствола мозга, бледного шара и зрительного бугра. Такие изменения, свидетельствующие о демиелинизации и глиозе, характерны главным образом для позднего варианта ДРПЛА. КТ при ДРПЛА менее информативна и выявляет диффузные атрофические изменения в супра- и субтенториальных отделах мозга. «Золотым стандартом» диагностики является прямая ДНК-диагностика.
Прогноз неблагоприятный; продолжительность жизни после появления первых симптомов заболевания редко превышает 15-20 лет.
• Сенильная хорея
Спорадическое заболевание, встречающееся у лиц старше 60 лет. Этиология и патогенез не установлены. Морфологический субстрат – дегенерация нейронов в хвостатом ядре и скорлупе, не достигающая степени, характерной для ХГ. Изменения в коре больших полушарий отсутствуют. Клиника: исподволь развивающийся и медленно прогрессирующий хореиформный гиперкинез, обычно в конечностях и орофациальной мускулатуре. Выраженность его минимальная или умеренная, имеется наклонность к замедлению, а в дальнейшем к приостановке процесса. Психические изменения для сенильной хореи не характерны.
• Сосудистая хорея
Чаще всего возникает при ишемическом инфаркте или кровоизлиянии в области хвостатого ядра или скорлупы, реже – бледного шара и таламуса, а также путей, соединяющих эти образования между собой и с лобными долями. Обычно сосудистая хорея развивается остро по геми-типу. Описаны единичные случаи двухсторонней хореи при двухстороннем инфаркте хвостатого ядра и даже при одностороннем поражении парамедианного отдела таламуса. Отставленная гемихорея (постгемиплегическая хорея, или синдром Минковского) – редкое состояние, возникающее на фоне регресса гемипареза через несколько недель – лет после инсульта, вовлекающего базальные ганглии. Упоминаются казуистические случаи хореи, имевшей прогрессирующее течение и напоминавшей ХГ, которые были связаны с множественными двухсторонними инфарктами в хвостатом ядре, скорлупе, внутренней капсуле. Сообщалось о случаях генерализованной хореи у больных с двухсторонней окклюзией внутренних сонных артерий, регрессировавшей после наложения экстра-интракаротидного анастомоза. Хорея с выраженным дистоническим компонентом может развиваться после поражения парамедианного отдела среднего мозга (наряду с прочими признаками поражения среднего мозга).
Особенностью сосудистой хореи является её сочетание с некоторыми чертами дистонии (например, постоянной позной установкой – избыточным сгибанием/разгибанием, вращением), атетоза, стереотипиями, а также с пирамидными, чувствительными, атактическими и нейропсихическими нарушениями (например, манией).
В большинстве случаев остро развившейся сосудистой хореи отмечается регресс гиперкинеза в течение нескольких недель – месяцев, но иногда он бывает более стойким.
• Хорея беременных
Для неё типично начало на 3-5-м месяце беременности. В течение короткого промежутка времени хореический гиперкинез достигает своего максимума. Насильственные движения более быстрые и размашистые, чем при ХГ, они истощают больного. Следует помнить, что беременность может выступать для ХГ провоцирующим фактором.
• Лекарственные и интоксикационные (в т.ч. алкогольные) дискинезии
Лекарственная хорея [6] может являться побочным эффектом ряда препаратов: метоклопрамида, амоксапина, препаратов леводопы, агонистов дофамина, амантадина, холинолитиков, препаратов вальпроевой кислоты (при приёме в высоких дозах и длительно, особенно в сочетании с фенитоином), фенобарбитала, гексамидина, карбамазепина, этосуксимида, психостимуляторов (метамфетамин, метилфенидат, кокаин, кофеин), эстрогенов и оральных контрацептивов, ксантинов (эуфиллин, теофиллин), три- и тетрациклических антидепрессантов, антагонистов кальция, резерпина, препаратов лития, Н2-антагонистов (циметидин, ранитидин). Преходящая, но иногда весьма тяжёлая хорея может возникнуть при внезапной отмене бензодиазепинов (особенно клоназепама) или нейролептиков. После отмены препарата хореические гиперкинезы постепенно регрессируют, как правило, в течение нескольких недель.
Описаны хореические гиперкинезы при отравлении окисью углерода, а также при алкогольной интоксикации.
Относительно часто хореический гиперкинез встречается при хронической печёночной энцефалопатии. Он в первую очередь вовлекает мышцы лица и языка (частое высовывание языка, гримасничанье), в последующем могут вовлекаться мышцы шеи, туловища и конечностей. Гиперкинез усиливается при произвольных движениях вовлечённой части тела.
• Атаксия-телеангиэктазия Луи-Бар
Заболевание из группы нейрокожных синдромов (факоматозов) с аутосомно-рецессивным типом наследования; ген локализован на 11-й хромосоме (11q22-23). Характеризуется мозжечковой атаксией, которая становится заметной в период приобретения ребёнком навыков ходьбы, дизартрией, глазодвигательными нарушениями, хореоатетозом, миоклонией, эндокринными нарушениями. Патогномоничные кожные изменения (телеангиэктазии) появляются в 3-6 лет, чаще всего начиная с конъюнктивы глаз.
Отличительной особенностью болезни являются рецидивирующие бактериальные и вирусные инфекции, связанные с дефектами иммунитета, ассоциация с лимфомами, лейкозом у пациентов молодого возраста.
При КТ/МРТ выявляют прогрессирующую атрофию мозжечка (преимущественно червя), вторичное расширение IV желудочка, постгеморрагические очаги в паренхиме мозга, появление которых связано с кровоизлияниями из эктазированных сосудов.
Болезнь Фара (семейный стриато-паллидо-дентатный кальциноз) – редкое наследственное заболевание, характеризующееся симметричной кальцификацией вещества головного мозга, прежде всего в области базальных ганглиев и зубчатых ядер мозжечка. Выделяют ювенильную (дебют у детей и подростков) и сенильную (дебют в среднем и пожилом возрасте) формы болезни. Если сенильная форма в подавляющем большинстве случаев характеризуется синдромом паркинсонизма, то при ювенильной возможно развитие хореических гиперкинезов (иногда – с умственной отсталостью).
Решающим для диагностики является КТ-исследование головного мозга: кальцификация должна иметь распространённый характер.
Значительно реже встречается синдром Фара – при гипопаратиреозе и псевдогипопаратиреозе.
• Церебральные васкулиты (в том числе при СКВ, узелковом периартериите, АФС и нейросифилисе)
Хорея является самым частым экстрапирамидным синдромом, развивающимся при СКВ (т.н. «волчаночная хорея»), но наблюдается она лишь у 1% больных СКВ [59]. Диагностика хореи особенно трудна, если она опережает, иногда на несколько месяцев и даже лет, другие проявления СКВ и возникает в отсутствие признаков системного воспалительного процесса. Клинически волчаночная хорея напоминает хорею Сиденгама. Она также чаще поражает лиц женского пола, но пик заболеваемости приходится не на детский и подростковый возраст, а на 20-30 лет. Хорея бывает односторонней или генерализованной, нарастает подостро или постепенно, затем стабилизируется и заканчивается полным спонтанным восстановлением. Продолжительность эпизода составляет несколько недель – месяцев. Нередко хорея сопровождается психическими изменениями (например, обсессивно-компульсивным синдромом) или другой очаговой неврологической симптоматикой. Приём кортикостероидов ускоряет регресс хореи. Через несколько месяцев – лет она может рецидивировать, иногда в связи с беременностью или приёмом оральных контрацептивов. МРТ при волчаночной хорее чаще не выявляет изменений, но у некоторых больных обнаруживаются очаги в хвостатом ядре, иногда – более обширные множественные изменения в базальных ганглиях, таламусе, коре больших полушарий. Впрочем, аналогичные изменения выявляются у больных СКВ без хореи. Не выявляется изменений и в ликворе.
Хореический гиперкинез является основным проявлением экстрапирамидной патологии и при АФС. Он может быть начальным симптомом и опережать другие проявления болезни на несколько лет. Однако чаще хорея возникает на фоне других неврологических проявлений АФС: мигренеподобной головной боли, эпилептических припадков, повторяющихся эпизодов тромбозов мелких мозговых артерий, накапливающийся после которых дефект приводит к развитию мультиинфарктной деменции преимущественно коркового типа. Регресс хореического синдрома происходит в большинстве случаев в течение 3-6 месяцев.
Единичные случаи хореиформного гиперкинеза описаны у больных менинговаскулярным сифилисом.
Болезнь Альцгеймера – первичное дегенеративное заболевание головного мозга, возникающее обычно после 50 лет и характеризующееся прогрессирующим снижением интеллекта, нарушением памяти и изменениями личности. Как правило, дебютирует с фиксационной амнезии, к которой постепенно присоединяются нарушения долговременной памяти, а затем и прочих мозговых функций. Экстрапирамидные нарушения могут присоединяться на поздних стадиях болезни, наряду с судорожными припадками и миоклониями.
Болезнь Пика – редкое прогрессирующее деструктивное заболевание головного мозга, клинически сходное с болезнью Альцгеймера, протекающее с нарушениями логического мышления и восприятия, апатией и амнезией, афазией. Морфологически имеется ограниченная атрофия коры лобных и височных долей. На поздних стадиях могут присоединяться экстрапирамидные расстройства.
• Болезнь Крейтцфельда – Якоба
Болезнь Крейтцфельда – Якоба – редкое нейродегенеративное заболевание из группы прионных болезней. Хореоатетоз и баллизм встречаются при этом заболевании крайне редко, как правило, в развёрнутой стадии. Болезнь характеризуется 100% летальным исходом, 90% больных умирают в течение года от дебюта, в единичных случаях больные остаются в живых до 5 лет.
• Рассеянный склероз
В дебюте рассеянного склероза, хотя и достаточно редко, возможно возникновение неэпилептических пароксизмальных феноменов, связанных с эктопической генерацией импульсов в зоне демиелинизации. К ним относятся пароксизмальные гиперкинезы, в том числе и хореиформные. Дебют рассеянного склероза чаще приходится на молодой возраст (15-25 лет). Важное диагностическое значение имеет выявление симптомов Лермитта (ощущение прохождения тока по спине и конечностям при наклоне головы кпереди) и Утхофа (преходящее нарастание выраженности симптоматики при повышении температуры, например, при приёме горячей ванны), а также МРТ головы/спинного мозга и исследование зрительных вызванных потенциалов.
• Шизофрения
Ещё до развития явных признаков заболевания при ХГ отмечается повышенная возбудимость и снижение тормозных функций, особенно социально обусловленных, что дало повод некоторым авторам даже говорить о «хореопатии» (F.A. Kehrer, 1928 – цитируется по [1]). Больным ХГ свойственна асоциальность и особая импульсивность, иногда имеют место аффективные вспышки с психомоторным возбуждением, бессмысленными побегами, что является поводом для помещения таких лиц в психиатрические учреждения. В таких случаях дифференциальный диагноз с шизофренией весьма затруднителен и требует тщательного сбора семейного анамнеза и динамического наблюдения за больным.
• Сосудистая деменция
При сочетании сосудистой хореи с сосудистой деменцией могут возникать затруднения в дифференциальной диагностике с ХГ. Помогает тщательный сбор семейного анамнеза, наличие сосудистых изменений на МРТ, динамическое наблюдение за больным.
• НейроСПИД
Экстрапирамидные симптомы развиваются лишь у 2-3% больных СПИДом, главным образом, ВИЧ-энцефалопатией. Как правило, это паркинсонизм, но возможно развитие хореи и баллизма. Чаще всего они развиваются у больных с уже установленным диагнозом СПИДа, но изредка бывают дебютным симптомом ВИЧ-инфекции. В большинстве случаев они имеют односторонний характер, по типу гемихореи и гемибаллизма, и связаны с церебральным токсоплазмозом. Диагноз токсоплазмоза подтверждается серологически или положительными результатами пробного двухнедельного курса противотоксоплазменной терапии (сульфазидин, пириметаприм). Реже причиной хореических гиперкинезов служат нейросифилис или ВИЧ-энцефалопатия.
• Энцефалиты
При различных энцефалитах у взрослых, в том числе при клещевом, хореический синдром развивается в течение 1-3 дней, на фоне повышенной температуры, при наличии умеренного менингеального синдрома и плеоцитоза ликвора. Прогноз таких гиперкинезов в случае выздоровления благоприятный. Затруднения при дифференциальной диагностике могут возникнуть лишь в тех случаях, когда инфекционный процесс ускорил проявление ХГ. Помогает учёт эпидемиологической обстановки, тщательно собранный анамнез и динамическое наблюдение.
• Истинная полицитемия
Истинная полицитемия (болезнь Вакеза – Ослера) – хроническое миелопролиферативное заболевание, связанное с гиперплазией эритроидного, в меньшей степени – гранулоцитарного или мегакариоцитарного ростков кроветворения, обычно дебютирующее в среднем возрасте. Хорея относится к редким неврологическим осложнениям болезни (наиболее частое – тромбоз мозговых сосудов). Гиперкинезы вовлекают преимущественно мышцы лица, рта, языка, рук. Возникают обычно остро, чаще у женщин старше 50 лет, и регрессируют на фоне лечения полицитемии. Могут быть связаны и с инфарктом в области хвостатого ядра. Основные критерии диагностики истинной полицитемии – повышение массы эритроцитов (>36мл/кг у мужчин, >32 мл/кг у женщин), насыщение артериальной крови кислородом выше 92% и спленомегалия.
• Гипергликемическая некетотическая энцефалопатия
Осложнение сахарного диабета, характеризующееся высокой гиперосмолярностью крови, что сопровождается выраженными и разнообразными неврологическими нарушениями. Первым проявлением развивающейся некетотической гиперосмолярной комы иногда бывают эпилептические припадки, обычно нехарактерные для диабетического кетоацидоза, как генерализованные, так и парциальные. В ряде случаев отмечается гемихорея. В результате быстрого нарастания гиперосмолярности развивается метаболическая демиелинизация в области моста и других отделов ЦНС.
• Гипертиреоз
Изредка при гипертиреозе развиваются хорея или хореоатетоз, иногда асимметричные. Обычно они полностью или частично регрессируют на фоне тиреотоксических средств и бета-блокаторов.
Следует отметить, что в литературе описаны случаи фенотипа ХГ без наличия соответствующей мутации гена 4p16.3. Предполагается, что фенокопии ХГ обусловлены мутациями других, пока не идентифицированных генов [9] [76].
Течение и прогноз
В целом заболевание характеризуется неуклонно прогрессирующим течением, прогноз для жизни неблагоприятен. Средняя продолжительность жизни при ХГ составляет 52 года [1].
При классической форме ХГ гиперкинезы достигают своего максимума через 5-10 лет после начала болезни; впоследствии они либо сохраняются на прежнем уровне, либо маскируются по мере нарастания экстрапирамидной ригидности, которое знаменует собой переход в позднюю акинетико-ригидную форму.
Продолжительность жизни от момента появления первых симптомов при классической форме составляет 15-20 лет. Больные погибают как правило от интеркуррентных инфекций (аспирационной пневмонии, сепсиса, развивающегося вследствие пролежней), кахексии или вследствие суицида. В случае поздней манифестации ХГ (в 60-70 лет), наблюдающейся обычно при минимальной степени экспансии тринуклеотидных ЦАГ-повторов, заболевание прогрессирует очень медленно, а выраженная деменция развивается редко. Такой вариант чаще наблюдается при наследовании гена ХГ от больной матери.
Создав и проанализировав компьютерную модель эволюции ХГ (от приматов до будущих поколений), исследователи пришли к выводу, что экспансия тринуклеотидных ЦАГ-повторов будет неотвратимо нарастать, что приведёт к росту заболеваемости ХГ [60].
Лечение
Специфической фармакотерапии ХГ до настоящего времени не существует. Иногда хореические гиперкинезы возможно подавить с помощью лекарств, но тогда на первый план выступают их серьёзные побочные эффекты. Справедливости ради следует отметить, что сами гиперкинезы не так сильно беспокоят пациентов, а их подавление не означает восстановления нарушенных функций нервной системы.
К средствам симптоматической терапии, наиболее часто применяемых при ХГ, относятся следующие.
♦ Антипсихотики
Галоперидол – представитель группы нейролептиков-производных бутирофенона, эффективен при насильственных хореоатетотических движениях конечностей и лицевой мускулатуры. Назначать его при ХГ следует только в случае, если все остальные препараты показали свою неэффективность, т.к. галоперидол является мощным антагонистом дофаминовых рецепторов. Терапевтические дозы для взрослых 2,5-90 мг/сут, для детей – 0,5 мг/кг/сут, разделённые на 2-3 приёма. Начальная доза – по 1 мг 2 раза в сутки с увеличением дозы каждые 3-4 дня до достижения терапевтического эффекта [5]. Выпускается в форме таблеток по 1мг, 1,5мг и 5 мг. Противопоказан при документированной гиперчувствительности к производным бутирофенона, закрытоугольной глаукоме, панцитопении, тяжёлых заболеваниях сердца и печени, тяжёлой артериальной гипотензии, подкорковых повреждениях головного мозга, депрессии, беременности. Побочные эффекты: генерализованная ригидность и неспособность ходить/говорить может развиваться у пациентов с тиреотоксикозом; артериальная гипотензия; существенное повышение температуры тела; поздние дистонии; злокачественные нейролептический синдром; акатизия; общая слабость; агранулоцитоз; обтурационная желтуха; симптомы несахарного диабета; депрессия. С осторожностью применять у больных с судорогами в анамнезе. Во время лечения противопоказано употребление алкоголя. Взаимодействия: усиливает эффект антигипертензивных средств; повышает сывороточную концентрацию трициклических антидепрессантов; при совместном назначении препаратов лития развивается энцефалопатия; комбинация с АХЭП повышает внутриглазное давление; фенобарбитал и карбамазепин сижают эффективность галоперидола.
Рисперидон – атипичный антипсихотик, производное бензоксизола. Угнетая двигательную активность и ослабляя агрессивность, в меньшем проценте случаев, чем галоперидол, вызывает паркинсонизм. Выпускается в таблетках по 1, 2, 3 и 4 мг; растворе для приёма внутрь 1 мг/мл, 30 и 100 мл. Начальная доза для взрослых – 0,5-1 мг/сут в 1-2 приёма. В течение 3-5 дней дозу постепенно повышают до появления эффекта или развитя побочных действий (не более 6 мг/сут). Детям до 15 лет не рекомендуется. Противопоказан при документированной гиперчувствительности, беременности и кормлении грудью. Побочные эффекты: нарушения сна, сонливость, повышенная возбудимость, беспокойство, тревога, головная боль, головокружение, экстрапирамидные расстройства, поздняя дискинезия, злокачественный нейролептический синдром, боли в животе, диспепсия, ринит, галакторея, гинекомастия, изменения менструального цикла и сексуальной сферы, увеличение массы тела, отёки, гипотония, тахикардия (при высоких начальных дозах), сыпи. С осторожностью назначают пациентам с инфарктом миокарда в анамнезе, нарушением внутрисердечной проводимости, инсультом. Взаимодействия: уменьшает эффект леводопы и агонистов дофамина; флуоксетин, трициклические антидепресанты и бета-блокаторы могут повышать концентрацию рисперидона в плазме; усиливает гипотензивный эффект других препаратов.
♦ Бензодиазепины
Как правило, применяются при сопутствующих тревожных расстройствах. Основные представители этой группы, применяемые при ХГ, – клоназепам (таблетки по 0,25мг, 0,5мг, 1мг и 2мг) и диазепам (таблетки по 2мг, 5мг и 10мг; раствор для инъекций 0,5% 2 мл (10мг)).
Начальная доза клоназепама для взрослых составляет по 0,25мг 2 р/д с постепенным увеличением до 2-4 мг/сут (повышать дозу следует очень медленно!). Для детей терапевтическая доза составляет 0,005-0,01 мг/кг/сут, разделённая на 3 приёма. Противопоказания: документированная гиперчувствительность к бензодиазепинам; нарушение функции печени и почек; миастения; беременность. Побочные эффекты: усиление хореиформных подёргиваний; дизартрия; нарушения зрения; нистагм; гемипарезы; депрессия; психотические реакции; нарушение кратковременной памяти; сердцебиение; миастения и миалгия; диспепсия; нарушение функции печени и почек; анорексия; ксеростомия; угнетение дыхания; задержка мочи; алопеция; гирсутизм; анемия; агранулоцетоз и лейкопения; привыкание; лекарственная зависимость; синдромы отмены и последействия. Ограничено применение при глаукоме, ХОБЛ и грудном вскармливании. Взаимодействия: усиливает влияние алкоголя, нейролептиков, анальгетиков, миорелаксантов.
Дозы диазепама для взрослых – от 2 до 10 мг 2-4 р/д. Диазепам оказывает дозозависимое действие на ЦНС: в малых дозах (2-15 мг/сут) – стимулирующее, в больших (15 мг/сут и более) – седативное. Противопоказан при документированной гиперчувствительности к бензодиазепинам; острых заболеваниях печени и почек с нарушением их функции; миастении; закрытоугольной глаукоме; в первом триместре беременности; при лактации. Побочные эффекты: привыкание, синдром отмены, синдром последействия (мышечная слабость, снижение работоспособности), парадоксальные реакции (развитие тревоги, галлюцинаций, судорог, бессонницы), сонливость, ухудшение кратковременной памяти, атаксия, дизартрия, головная боль, головокружение, гипотония и брадикардия (диазепам – слабый симпатолитик), поражение печени и почек (при длительном использовании), атония кишечника, снижение либидо и потенции, местные реакции в месте введения. Взаимодействия: усиливает эффекты алкоголя, противосудорожных и гипотензивных средств, анальгетиков, снотворных. Ингибиторы МАО, аналептики, психостимуляторы снижают активность диазепама. Смешивание в одном шприце диазепама с другими препаратами не допускается (возможно выпадение препарата в осадок).
♦ Препараты вальпроевой кислоты
Препараты вальпроевой кислоты (депакин, конвулекс и др.) известны как антиконвульсанты, стабилизаторы настроения при маниях и профилактическое средство при мигрени. При ХГ они применяются в лечении мышечных спазмов. Начальная доза для взрослых составляет 300 мг/сут, возможен однократный приём (период полужизни составляет от 6 до 16 часов в зависимости от активности микросомальных ферментов печени). Дозу постепенно прибавляют, доводя до 2000 мг/сут в 2-3 приёма. Противопоказания: гиперчувствительность, в том числе «семейная» (смерть близких родственников на фоне приёма вальпроевой кислоты); заболевания печени и поджелудочной железы; геморрагический диатез; первый триместр беременности; лактация. Побочные эффекты: тромбоцитопения и повышение ВСК (кровотечения, подкожные кровоизлияния); гипераммониемия, приводящая к поражению печени (общее недомогание, усталость, отёчность лица, снижение аппетита, желтуха, тошнота, рвота); повышение аппетита; боли в желудке; сонливость; тремор; парестезии; спутанность сознания; лейкопения. При длительном приёме возможно обратимое выпадение волос. Взаимодействия: эффект усиливают другие противосудорожные, седативные и снотворные средства; диспептические расстройства встречаются реже на фоне приёма спазмолитиков и обволакивающих средств; циметидин, салицилаты, фелбамат, эритромицин, алкоголь усиливают токсичность. Вальпроевая кислота может существенно изменять концентрацию карбамазепина, повышать токсичность диазепама и этосуксимида, повышать концентрацию фенобарбитала и дифенина (в то время как они могут снижать концентрацию вальпроевой кислоты).
♦ Алкалоиды раувольфии змеиной
Основной представитель этой группы – резерпин – обладает способностью истощать запасы дофамина в нервных клетках, что обусловливает его нейролептический эффект. Резерпин выпускается в таблетках по 0,1 и 0,25мг. Начальная доза для взрослых – 0,05-0,1 мг 1 раз в сутки. Дозу следует постепенно и осторожно прибавлять на 0,05 мг в неделю до достижения эффекта или до развития побочных эффектов. Эффект развивается через несколько дней и достигает максимума через 3-6 недель. Противопоказан при документированной гиперчувствительности, артериальной гипотензии, эпилепсии, паркинсонизме, выраженной депрессии, язвенной болезни желудка и двенадцатипёрстной кишки, язвенном колите, дыхательной недостаточности, феохромоцитоме, жёлчнокаменной болезни, глаукоме, беременности и лактации. Побочные эффекты: лекарственный паркинсонизм, головная боль, головокружение, слабость, сонливость, депрессивное состояние, гипорефлексия, нарушение концентрации внимания, диспепсия (тошнота, рвота, диарея, боли в животе, анорексия), желудочно-кишечное кровотечение, ксеростомия, брадикардия, аритмии, боль в груди, периферические отёки, затруднённое и учащенное мочеиспускание, снижение либидо и потенции, аллергические реакции. Взаимодействие: усиливает эффекты алкоголя, средств, угнетающих ЦНС, бета-адреноблокаторов, антидепрессантов-ингибиторов МАО, гипотензивных препаратов. При совместном назначении с препаратами наперстянки и хинидина способствует возникновению аритмий. Снижает эффективность противопаркинсонических средств и симпатомиметиков.
♦ Антидепрессанты
Депрессия при ХГ встречается довольно часто и требует медикаментозного лечения сразу же после её диагностики. В принципе, при ХГ можно применять любые антидепрессанты, однако препаратами выбора всё же являются ингибиторы обратного захвата серотонина благодаря небольшому числу побочных эффектов, удобному дозированию и отсутствию опасности передозировки [58].
Пароксетин – представитель этой группы антидепрессантов – выпускается в таблетках по 20мг. Большинство пациентов предпочитают принимать его утром из-за развития стимулирующего эффекта. При наличии седатирующего эффекта препарат следует принимать в вечернее время. Начальная доза для взрослых – 10-20 мг/сут во время еды. При недостаточном эффекте дозу можно увеличивать на 10 мг с интервалом в 1 неделю до максимальной 40-60 мг/сут. Для оценки терапевтической эффективности требуется 6-8 недель. Противопоказания: документированная гиперчувствительность, одновременное назначение ингибиторов МАО и период в течение 14 дней после их отмены. Побочные эффекты: сухость во рту, тошнота, астения, сонливость или бессонница, тремор, потливость, нарушение либидо, аноргазмия и расстройства эякуляции, повышение риска суицида, гипоманиакальные/маниакальные состояния. С осторожностью назначают при наличии судорог, маниакальных эпизодов, почечном или сердечном заболевании в анамнезе. Взаимодействия: усиливает эффекты барбитуратов, дифенина, непрямых антикоагулянтов, трициклических антидепрессантов, фенотиазиновых нейролептиков и антиаритмиков класса 1с (пропафенон, флекаинид). Фенобарбитал и дифенин снижают эффективность. Алкоголь, циметидин, сертралин, фенотиазиновы нейролептики и непрямые антикоагулянты усиливают токсичность.
Перспективные направления лечения
Ингибитор высвобождения глутамата, рилузол, назначаемый при боковом амиотрофическом склерозе, показал свои защитные свойства на мышиной модели при токсическом воздействии квинолатов [45]. Открытые клинические испытания рилузола у больных ХГ подтвердили временное улучшение двигательных функций после его приёма.
На группе из 72 пациентов, страдающих ХГ, была показана неэффективность препаратов альфа-токоферола [54]. Неэффективным оказался и другой антиоксидант – идебенон [56].
В исследовании [63] было установлено, что экспрессия аномального экзона гентингтина при ХГ в культуре клеток вызывает снижение уровня ацетилированных гистонов Н3 и Н4; этот эффект обратим при добавлении ингибиторов гистондеацетилазы. In vivo, на модели дрозофил, ингибиторы гистондеацетилазы останавливают прогрессирующую нейрональную дегенерацию, индуцированную полиглутаминовой экспансией. Авторы предполагают, что препараты на основе ингибиторов гистондеацетилазы способны замедлить или предотвратить развитие ХГ (и других «полиглутаминовых» болезней, к которым относится спинобульбарная мышечная атрофия Кеннеди, ДРПЛА и группа аутосомно-доминантных спиноцеребеллярных атаксий, типы 1, 2, 3, 6, 7, 12 и 17) даже после её манифестации.
В работе [62] было показано, что при обработке культуры клеток препаратом гельданамицином (бензохинон-анзамицином) индуцируется экспрессия белка теплового шока HSP-40, HSP-70 и HSP-90 и подавляется агрегация белка экзона-1 гена HD.
В 2001г. были получены сведения, что гентингтин опосредованно через регуляцию транскрипции стимулирует синтез мозгового нейротрофического фактора BDNF – вещества, необходимого для жизнедеятельности нейронов стриатума [78], – а также усиливает его везикулярный транспорт вдоль микротрубочек [23]. Аномальный хантингтин утрачивает эту функцию, что приводит к снижению продукции BDNF в коре. Стриарные нейроны лишаются нейротрофической поддержки и погибают. В связи с этим одним из направлений лечения является восстановление синтеза BDNF.
В 2002г. группой исследователей [36] были созданы и испытаны супресорные полипептиды, связывающие аномальный гентингтин и нарушающие процессы агрегации в культуре клеток млекопитающих. Одним из направлений терапии ХГ авторы считают разработку препаратов, направленно нарушающих процессы взаимодействия белков, ведущие к формированию агрегатов.
Протеолиз мутантного гентингтина играет ключевую роль в патогенезе ХГ. Фрагменты мутантного гентингтина, содержащие полиглутаминовые повторы, образуют внутриклеточные включения, более цитотоксичные, чем неповреждённый аномальный гентингтин. Предполагается [44], что основными ферментами протеолиза, отвечающими за формирование таких фрагментов, являются аспартат-эндопептидазы. Специфическое ингибирование протеолитических процессов – одно из перспективных направлений лечения ХГ. В частности, показан положительный эффект перорального приёма трегалозы – дисахарида, наиболее существенно ингибирующего полиглутамин-опосредованную агрегацию белка, – на трансгенной мышиной модели ХГ [65].
Определённые надежды возлагаются на терапевтический эффект миноциклина – ингибитора капсазы-1 из группы тетрациклинов второго поколения [15]. Возможно, учитывая его низкую стоимость и хорошую переносимость, миноциклин будет входить в состав лекарственного антиапоптотического «коктейля»: выяснилось, что ингибирования только капсазы-1 недостаточно, необходимо воздействие ещё, по меньшей мере, на капсазу-3; таким эффектом in vitro обладает цистамин [41]. На крысиной модели ХГ показан антиапоптозный и нейропротективный эффект тауроурсодеоксихолевой кислоты (гидрофильная желчная кислота, в норме эндогенно синтезируемая в человеческом организме в очень малых концентрациях) по отношению к нейронам стриатума [37].
Большим терапевтическим потенциалом обладает метод пересадки эмбриональных нервных клеток или стволовых клеток больным нейродегенеративными заболеваниями, в том числе и ХГ. В исследовании [22] показано, что через 18 месяцев после пересадки фетального стриатума в головной мозг больных ХГ трансплантат не подвергается процессам, происходящим в стриатуме пациента, в частности, в трансплантате не обнаруживается агрегатов аномального гентингтина. Тем не менее, даже при отработке технологии пересадки фетального стриатума остаётся проблема поражения других участков мозга [25].
Предложена также методика пересадки генноинженерных клеток, способных секретировать различные факторы роста, в том числе фактор роста нервов и BDNF [7].
Заключение
Несмотря на небольшое абсолютное число больных ХГ в мире, это заболевание является одним из «краеугольных камней» в современной неврологии, в котором заключены проблемы молекулярной генетики, избирательного нейронального повреждения, эксайтотоксичности, митохондриальной дисфункции, апоптоза и дизрегуляции механизмов генной транскрипции. Достаточно сказать, что идея эксайтотоксичности – перевозбуждения нейронов, приводящего к их гибели, – впервые стала рассматриваться в контексте ХГ [16][48][50]; теперь же эксайтотоксичность считается ведущим патогенетическим механизмом для большинства неврологических заболеваний.
Кроме того, ХГ является классическим примером этической проблемы, связанной с невозможностью что-либо изменить, опираясь на имеющиеся у нас знания. В работе американского нейропсихолога и генетика Нэнси Векслер [72], мать которой страдала болезнью Хантингтона, эта проблема была названа «комплексом Тирезия». В трагедии Софокла «Царь Эдип» слепец Тирезий сказал Эдипу: «Печально быть мудрым, если мудрость твоя бесполезна». Применительно к такой фатальной болезни, как ХГ, Н.Векслер формулирует дилемму Тирезия следующим образом: «Хотели бы Вы знать, когда и как Вы умрёте, особенно если у Вас нет возможности изменить ход событий? Следует ли делать такую информацию общедоступной? Как обречённому жить дальше с такой информированностью?».
В связи с этим трудно переоценить важность научных и клинических исследований, направленных на поиски средств эффективного лечения этого фатального заболевания.
СПИСОК ИСПОЛЬЗОВАННЫХ СОКРАЩЕНИЙ
АФС – антифосфолипидный синдром
АХЭП – антихолинэстеразные препараты
ВИЧ – вирус иммунодефицита человека
ВСК – время свёртывания крови
ГАМК – гамма-аминомасляная кислота
ДНК – дезоксирибонуклеиновая кислота
ДРПЛА – дентато-рубро-паллидо-льюисова атрофия
КТ – компьютерная томография
КФ – классификация ферментов (международная кодовая система классификации ферментов)
КФК – креатинфосфокиназа
МАО – моноаминоксидаза
МКБ-10 – международная классификация болезней 10-го пересмотра
МРТ – магнитно-резонансная томография
ОРЗ – острое респираторное заболевание
ОФЭКТ – однофотонная эмиссионная компьютерная томография
ПЭТ – позитронная эмиссионная томография
СКВ – системная красная волчанка
СПИД – синдром приобретённого иммунодефицита
ХГ – хорея Гентингтона
ХОБЛ – хроническая обструктивная болезнь лёгких
ЦАГ – цитозин-аденин-гуанин
ЦНС – центральная нервная система
ЭНМГ – электронейромиография
ЭЭГ – электроэнцефалография
BDNF – brain-derived neurotrophic factor (мозговой нейротрофический фактор)
HARP – hypobetalipoproteinemia, acanthocytosis, retinitis, pallidar degeneration
HSP – heat shock protein (белок теплового шока)
NMDA-рецепторы – N-метил-D-аспартатные рецепторы
OMIM – Online Mendelian Inheritance in Men (международная система классификации моногенных наследственных заболеваний)
СПИСОК ЛИТЕРАТУРЫ
- Аносов Н.Н. Хорея Хантингтона (наследственная хорея, хроническая прогрессирующая хорея, хореическая деменция) // Многотомное руководство по неврологии. – М.:Медгиз, 1960. – Т.7. – С.281-295.
- Болезни нервной системы: Руководство для врачей в 2-х томах / под ред. Н.Н.Яхно, Д.Р.Штульмана, П.В.Мельничука. – 1995. – т.2. – С.177-180.
- Классификации болезней нервной системы: Пособие для врачей / под ред. Н.Г.Дубовской. – М.:Триада-Х, 2002. – С.192.
- Петрухин А.С. Неврология детского возраста: Учебник. – М.:Медицина, 2004. – С.453-457.
- Справочник-путеводитель практикующего врача. 2000 болезней от А до Я / под ред. И.Н.Денисова, Ю.Л.Шевченко. – 2-е изд. – М.: Гэотар-мед, 2003. – 1344с.
- Экстрапирамидные расстройства: Руководство по диагностике и лечению / под ред. В.Н.Штока, И.А.Ивановой-Смоленской, О.С.Левина. – М.:Медпресс-информ, 2002. – С.302-312.
- Alberch J., Perez-Navarro E., Canals J.M. Neuroprotection by neurotrophins and GDNF family members in the excitotoxic model of Huntington’s disease // Brain Res. Bull., 2002. – Vol.57. – P.817-822.
- Almqvist E.W., Elterman D.S., MacLeod P.M., Hayden M.R. High incidence rate and absent family histories in one quarter of patients newly diagnosed with Huntington disease in British Columbia // Clin.Genet., 2001. – Vol.60. – P.198-205.
- Andrew S.E., Goldberg Y.P., Kremer B., Squitieri F., Theilmann J., Zeisler J., Telenius H., Adam S., Almquist E., Anvret M., Lucotte G., Stoessl A.J., Campanella G., Hayden M.R. Huntington disease without CAG expansion: phenocopies or errors in assignment? // Am. J. Hum. Genet., 1994. – Vol.54. – P.852-863.
- Andrich J., Schmitz T., Saft C., Postert T., Kraus P., Epplen J.T., Przuntek H., Agelink M.W. Autonomic nervous system function in Huntington’s disease // J. Neurol. Neurosurg. Psychiatry, 2002. – Vol. 72. – P.726-731.
- Barbeau A. Parental ascent in the juvenile form of Huntington’s chorea. (Letter) // Lancet, 1970. – Vol.II. – P.937.
- Brinkman R.R., Mezei M.M., Theilmann J., Almqvist E., Hayden M.R. The likelihood of being affected withHuntingtondisease by a particular age, for a specific CAG size // Am.J.Hum.Genet., 1997. – Vol.60. – P.1202-1210.
- Bundey S. New mutations in Huntington’s chorea. (Letter) // J.Med.Genet., 1983. – Vol.20. – P.76-77.
- CampbellA.M.G., Corner B.D., NormanR.M., Urich H. The rigid form of Huntington’s disease // J. Neurol. Neurosurg. Psychiatry, 1961. – Vol.24. – P.71-77.
- Chen M., Ona V.O., Li M., Ferrante R.J., Fink K.B., Zhu S., Bian J., Guo L., Farrell L.A., Hersch S.M., Hobbs W., Vonsattel J.-P., Cha J.-H. J., Friedlander R.M. Minocycline inhibits caspase-1 and caspase-3 expression and delays mortality in a transgenic mouse model ofHuntingtondisease // Nature Med., 2000. – Vol.6. – P.797-801.
- Coyle J.T., Schwarcz R. Lesion of striatal neurons with kainic acid provides a model for Huntington’s chorea // Nature, 1976. – Vol.263. – P.244-246.
- Cudkowicz M., Kowall N.W. Degeneration of pyramidal projection neurons in Huntington’s disease cortex // Ann. Neurol, 1990. – Vol. 27. – P.200-204.
- DiFiglia M., Sapp E., Chase K.O., Davies S.W., Bates G.P., Vonsattel J.P., Aronin N. Aggregation of huntingtin in neuronal intranuclear inclusions and dystrophic neurites in brain // Science, 1997. – Vol.277. – P.1990-1993.
- Djousse L., Knowlton B., Hayden M.R. et al. Evidence for a modifier of onset age in Huntington disease linked to the HD gene in 4p16 // Neurogenetics, 2004. – Vol.5. – P.109-114.
- Erickson R.P. Chromosomal imprinting and the parent transmission specific variation in expressivity ofHuntingtondisease (Letter) // Am. J. Hum. Genet., 1985. – Vol.37. – P.827-829.
- Farrer L.A., Conneally P.M. A genetic model for age at onset inHuntingtondisease // Am. J. Hum. Genet., 1985. – Vol.37. – P.350-357.
- Freeman T.B., Cicchetti F., Hauser R.A., Deacon T.W., Li X.-J., Hersch S.M., Nauert G.M., Sanberg P.R., Kordower J.H., Saporta S., Isacson O. Transplanted fetal striatum in Huntington’s disease: phenotypic development and lack of pathology // Proc. Nat. Acad. Sci., 2000. – Vol.97. – P.13877-13882.
- Gauthier L.R., Charrin B.C., Borrell-Pages M., Dompierre J.P., Rangone H., Cordelieres F.P., De Mey J., MacDonald M.E., Lebmann V., Humbert S., Saudou F. Huntingtin controls neurotrophic support and survival of neurons by enhancing BDNF vesicular transport along microtubules // Cell, 2004. – Vol.118. – P.127-138.
- Goldberg Y.P., Nicholson D.W., Rasper D.M., Kalchman M.A., Koide H.B., Graham R.K., Bromm M., Kazemi-Esfarjani P., Thornberry N.A., Vaillancourt J.P., Hayden M.R. Cleavage of huntingtin by apopain, a proapoptotic cysteine protease, is modulated by the polyglutamine tract // Nature Genet.,1996. – Vol.13. – P.442-449.
- Greenamyre J.T., Shoulson I. We need something better, and we need it now: fetal striatal transplantation in Huntington’s disease? // Neurology, 2002. – Vol.58. – P.675-676.
- Gu M., Gash M.T., Mann V.M., Javoy-Agid F., Cooper J.M., Schapira A.H.V. Mitochondrial defect in Huntington’s disease caudate nucleus // Ann. Neurol., 1996. – Vol.39. – P.385-389.
- Gusella J.F., Wexler N.S., Conneally P.M., Naylor S.L., Anderson M.A., Tanzi R.E., Watkins P.C., Ottina K., Wallace M.R., Sakaguchi A.Y., Young A.B., Shoulson I., Bonilla E., Martin J.B. A polymorphic DNA marker genetically linked to Huntington’s disease // Nature, 1983. – Vol.306. – P.234-238.
- Gutekunst C.-A., Levey A.I., Heilman C.J., Whaley W.L., Yi H., Nash N.R., Rees H.D., Madden J.J., Hersch S.M. Identification and localization of huntingtin in brain and human lymphoblastoid cell lines with anti-fusion protein antibodies // Proc. Nat. Acad. Sci., 1995. – Vol.92. – P.8710-8714.
- Harper B. Huntington disease // Journal of the Royal Society of Medicine, 2005. – Vol.98. – P.550.
- Hayden M.R., Martin W.R.W., Stoessl A.J., Clark C., Hollenberg S., Adam M.J., Ammann W., Harrop R., Rogers J., Ruth T., Sayre C., Pate B.D. Positron emission tomography in the early diagnosis of Huntington’s disease // Neurology, 1986. – Vol.36. – P.888-894.
- Hedgreen J.C., Peyser C.E., Folstein S.E., Ross C.A. Neuronal loss in layers V and VI of cerebral cortex in Huntington’s disease // Neurosci. Lett., 1991. – Vol.133. – P.257-261.
- HuntingtonG. On chorea // Med. Surg. Reporter, 1872. – Vol. 26. – P.317-321.
- Huntington G. Recollections of Huntington’s chorea as I saw it at East Hampton,Long Islandduring my boyhood // Journal of Nervous and Mental Disease, Baltimore, 1910. – Vol.37. – P.255-257.
- Huff J.S. Huntington Chorea // www.emedicine.com, 2005.
- Juvenile Huntington’s disease. – Eds. M.Nance, R.Jones, S.Imbriglio, B.Gettig // www.hdsa.org, 2001.
- Kazantsev A., Walker H.A., Slepko N., Bear J.E., Preisinger E., Steffan J.S., Zhu Y.-Z., Gertler F.B., Housman D.E., Marsh J.L., Thompson L.M. A bivalent Huntingtin binding peptide suppresses polyglutamine aggregation and pathogenesis in Drosophila // Nature Genet., 2002. – Vol.30. – P.367-376.
- Keene C.D., Rodrigues C.M.P., Eich T., Chhabra M.S., Steer C.J., Low W.C. Tauroursodeoxycholic acid, a bile acid, is neuroprotective in a transgenic animal model of Huntington’s disease // Proc. Nat.Acad. Sci., 2002. – Vol.99. – P.10671-10676.
- Kerbeshian J., Burd L., Leech, C., Rorabaugh A. Huntington disease and childhood-onset Tourette syndrome // Am. J. Med. Genet., 1991. – Vol.39. – P.1-3.
- Kremer B., Goldberg P., Andrew S.E., Theilmann J., Telenius H., Zeisler J., Squitieri F., Lin B., Bassett A., Almqvist E., Bird T.D., Hayden M.R. A worldwide study of the Huntington’s disease mutation: the sensitivity and specificity of measuring CAG repeats // New Eng. J. Med., 1994. – Vol.330. – P.1401-1406.
- Leavitt B.R., Guttman J.A., Hodgson J.G., Kimel G.H., Singaraja R., Vogl A.W., Hayden M.R. Wild-type huntingtin reduces the cellular toxicity of mutant huntingtin in vivo // Am. J. Hum. Genet., 2001. – Vol.68. – P.313-324.
- Lesort M., Lee M., Tucholski J., Johnson G.V. Cystamine inhibits capsase activity. Implications for the treatment of polyglutamine disorders // J. Biol. Chem., 2003. – Vol.278. – P.3825-3830.
- LitvanI., Paulsen J.S., Mega M.S. et al. Neuropsychiatric assessment of patients with hyperkinetic and hypokinetic movement disorders // Arch. Neurol., 1998. – Vol. 55. – P.1313-1319.
- LundJ.C. Chorea Sti Viti i Saetersdalen. Uddrag af Distriktslåge J. C. Lunds Medicinalberetning for 1860 // Beretning om Sundhedstilstanden m.m. i Norge i 1860, P.137-138.
- Lunkes A., Lindenberg K.S., Ben-Haiem L., Weber C., Devys D., Landwehrmeyer G.B., Mandel J.-L., Trottier Y. Proteases acting on mutant huntingtin generate cleaved products that differentially build up cytoplasmic and nuclear inclusions // Molec. Cell, 2002. – Vol.10. – P.259-269.
- Mary V., Wahl F., Stutzmann J.M. Effect of riluzole on quinolinate-induced neuronal damage in rats: Comparison with blockers of glutamatergic neurotransmission // Neurosci. Lett., 1995. – Vol.201. – P.92-96.
- Mazziotta J.C., Frackowiak R.S.J., Phelps M.E. The use of positron emission tomography in the clinical assessment of dementia // Seminars in Nuclear Medicine, October 1992. – Vol. 21. – No.4. – P.233-246.
- Mazziotta J.C., Phelps M.E., Pahl J.J., Huang S.-C., Baxter L.R., Riege W.H., Hoffman J.M., Kuhl D.E., Lanto A.B., Wapenski J.A., Markham C.H. Reduced cerebral glucose metabolism in asymptomatic subjects at risk for Huntington’s disease // New Eng.J.Med., 1987. – Vol.316. – P.357-362.
- McGeer E.G., McGeer P.L. Duplication of biochemical changes of Huntington’s chorea by intrastriatal injections of glutamic acid and kainic acids // Nature, 1976. – Vol.263. – P.517-519.
- Metzler M., Helgason C.D., Dragatsis I., Zhang T., Gan L., Pineault N. et al. Huntingtin is required for normal hematopoiesis // Hum. Mol. Genet., 2000. – Vol.9. – P.387-394.
- Olney J.W., de Gubareff T. Glutamate neurotoxicity and Huntington’s chorea // Nature, 1978. – Vol.271. – P.557-559.
- OMIM +143100Huntingtondisease // www.ncbi.nlm.nih.gov/entrez/dispomim.cgi?id=143100
- Panov A.V., Gutekunst C.-A., Leavitt B.R., Hayden M.R., Burke J.R., Strittmatter W.J., Greenamyre J.T. Early mitochondrial calcium defects in Huntington’s disease are a direct effect of polyglutamines // Nature Neurosci., 2002. – Vol.5. – P.731-736.
- Paulsen J.S., Ready R.E., Hamilton J.M., Mega M.S., Cummings J.L. Neuropsychiatric aspects of Huntington’s disease // J. Neurol. Neurosurg. Psychiatry, 2001. – Vol. 71. – P.310-314.
- Peyser C.E., Folstein M., Chase G.A., Starkstein S., Brandt J., Cockrell J.R., Bylsma F., Coyle J.T., McHugh P.R., Folstein S.E. Trial of d-alpha-tocopherol in Huntington’s disease // Am. J. Psychiat., 1995. – Vol.152. – P.1771-1775.
- Portera-Cailliau C., Hedreen J.C., Price D.L., Koliatsos V.E. Evidence for apoptotic cell death in Huntington disease and excitotoxic animal models // J. Neurosci., 1995. – Vol.15. – P.3775-3787.
- Ranen N.G., Peyser C.E., Coyle J.T., Bylsma F.W., Sherr M., Day L. et al. A controlled trial of idebenone in Huntington’s disease // Mov. Disord., 1996. – Vol.11. – P.549-554.
- Reik W. Genomic imprinting: a possible mechanism for the parental origin effect in Huntington’s chorea // J. Med. Genet., 1988. – Vol.25. – P.805-808.
- Revilla F.J., Grutzendler J. Huntington disease // www.emedicine.com, 2005.
- Rosenbaum R.B., Campbell S.M., Rosenbaum J.T. Clinical Neurology of Rheumatic Diseases. –Boston: Butterworth-Heinemann, 1996. – 416p.
- Rubinsztein D.C., Amos W., Leggo J., Goodburn S., Ramesar R.S., Old J., Bontrop R., McMahon R., Barton D.E., Ferguson-Smith M.A. Mutational bias provides a model for the evolution of Huntington’s disease and predicts a general increase in disease prevalence // Nature Genet., 1994. – Vol.7. – P.525-530.
- Schwarcz R., Okuno E., White R.J., Bird E.D., Whetsell W.O. Jr. 3-Hydroxyanthranilate oxygenase activity is increased in the brains of Huntington disease victims // Proc. Nat. Acad. Sci., 1988. – Vol.85. – P.4079-4081.
- Sittler A., Lurz R., Lueder G., Priller J., Hayer-Hartl M.K., Hartl F.U., Lehrach H., Wanker E.E. Geldanamycin activates a heat shock response and inhibits huntingtin aggregation in a cell culture model of Huntington’s disease // Hum. Molec. Genet., 2001. – Vol.10. – P.1307-1315.
- Steffan J.S., Bodal L., Pallos J., Poelman M., McCampbell A., Apostol B.L., Kazantsev A., Schmidt E., Zhu Y.-Z., Greenwald M., Kurokawa R., Housman D.E., Jackson G.R., Marsh J.L., Thompson L.M. Histone deacetylase inhibitors arrest polyglutamine-dependent neurodegeneration in Drosophila // Nature, 2001. – Vol.413. – P.739-743.
- Stevanin G., Camuzat A., Holmes S.E., Julien C., Sahloul R., Dode C., Hahn-Barma V., Ross C.A., Margolis R.L., Durr A., Brice A. CAG/CTG repeat expansions at the Huntington’s disease-like 2 locus are rare in Huntington’s disease patients // Neurology, 2002. – Vol.58. – P.965-967.
- Tanaka M., Machida Y., Niu S., Ikeda T., Jana N.R., Doi H., Kurosawa M., Nekooki M., Nukina N. Trehalose alleviates polyglutamine-mediated pathology in a mouse model of Huntington disease // Nature Med., 2004. – Vol.10. – P.148-154.
- The Huntington Study Group. UnifiedHuntingtondisease rating scale: reliability and consistency // Mov. Disord., 1996. – Vol.11. – P.136-142.
- The Huntington’s Disease Collaborative Research Group. A novel gene containing a trinucleotide repeat that is unstable in Huntington’s disease chromosomes // Cell, 1993. – Vol.72. – P.971-983.
- Trushina E., Dyer R.B., Badger J.D. II et al. Mutant huntingtin impairs axonal trafficking in mammalian neurons in vivo and in vitro // Molec. Cell. Biol., 2004. – Vol.24. – P.8195-8209.
- van Dijk J.G., van der Velde E.A., Roos R.A.C., Bruyn G.W. Juvenile Huntington disease // Hum. Genet., 1986. – Vol.73. – P.235-239.
- Vonsattel J.P., Myers R.H., Stevens T.J., Ferrante R.J., Bird E.D., Richardson E.P. Neuropathological classification of Huntington’s disease // J. Neuropathol. Exp. Neurol., 1985. – Vol.44. – P.559-577.
- Warner J., Barron L., St Clair D., Brock D. Reliability of clinical diagnosis of Huntington’s disease (Letter) // J. Neurol. Neurosurg. Psychiat., 1994. – Vol.63. – P.1277.
- Wexler N. S. The Tiresias complex: Huntington’s disease as a paradigm of testing for late-onset disorders // FASEB Journal, 1992. – Vol.6. – P.2820-2825.
- White J.K., Auerbach W., Duyao M.P., Vonsattel J.P., Gusella J.F., Joyner A.L., MacDonald M.E. Hungtintin is required for neurogenesis and is not impaired by the Huntington’s disease CAG expansion // Nat. Genet., 1997. – Vol.17. – P.404-410.
- Wolff G., Deuschl G., Wienker T.F., Hummel K., Bender K., Lucking C.H., Schumacher M., Hammer J., Oepen G. New mutation to Huntington’s disease // J. Med. Genet., 1989. – Vol.26. – P.18-27.
- www.whonamedit.com
- Xiang F., Almqvist E.W., Huq M., Lundin A., Hayden M.R., Edstrom L., Anvret M., Zhang Z. AHuntingtondisease-like neurodegenerative disorder maps to chromosome 20p // Am. J. Hum. Genet, 1998. – Vol.63. – P.1431-1438.
- Zeitlin S., Liu J.P., Chapman D.L., Papaioannou V.E., Efstratiadis A. Increased apoptosis and early embryonic lethality in mice nullizygous gor the Huntington’s disease gene homologue // Nat. Genet., 1995. – Vol.11. – P.155-163.
- Zuccato C., Ciammola A., Rigamonti D., Leavitt B.R., Goffredo D., Conti L., MacDonald M.E., Friedlander R.M., Silani V., Hayden M.R., Timmusk T., Sipione S., Cattaneo E. Loss of huntingtin-mediated BDNF gene transcription in Huntington’s disease // Science, 2001. – Vol.293. – P.493-498.
© Широков С.Л., 2008







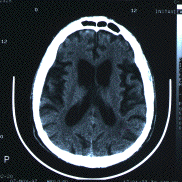
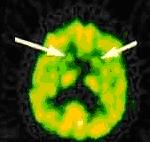
Комментарии