Guillaume Benjamin Amand Duchenne (1806-1875)
Wilhelm Griesinger (1881-1959)
Син.: болезнь Мериона.
Наследственное нервно-мышечное заболевание из группы прогрессирующих мышечных дистрофий. Самая частая форма Х-сцепленной прогрессирующей мышечной дистрофии. Следующей по частоте формой является миодистрофия Беккера(–Кинера).
Ген заболевания картирован на коротком плече Х-хромосомы (локус Xp21) и наследуется по рецессивному типу. Сущность Х-сцепленного рецессивного типа наследования пояснена в статье Беккера(–Кинера) (прогрессирующая) мышечная дистрофия <доброкачественная псевдогипертрофическая миодистрофия>. Там же приведены сведения о гене дистрофина (DYS), особенностях строения и функции его продукта – белка дистрофина, о дистрофинопатиях.
Частота прогрессирующей мышечной дистрофии Дюшенна варьирует от 9,7 до 32,6 на 100.000 живорождённых мальчиков. Высокая распространенность заболевания в популяции в значительной мере связана с высокой частотой новых мутаций гена дистрофина, самого крупного из известных генов человека. Средняя ожидаемая продолжительность жизни составляет 25 лет.
Крайне редко возможно развитие заболевания у девочек. Причин для этого может быть несколько: делеция на одной из Х-хромосом, вовлекающая локус Xp21; перестройка Х-хромосомы с вовлечением Xp21, или полное отсутствие одной из Х-хромосом (напр., при синдроме (Шерешевского–)Тёрнера); однородительская дисомия Х-хромосомы; сложная гетерозиготность по двум мутациям гена DYS; неслучайная инактивация Х-хромосомы.
В патогенезе заболевания, помимо непосредственного дефекта дистрофина, играют роль и иммунопатологические механизмы. У пациентов имеет место хронический воспалительный процесс и нарушение процессов регенерации. Реакции воспалительного каскада запускаются вскоре после рождения и обусловлены повышением содержания «воспалительных» генных кластеров в 8-10 месячном возрасте. За счёт дефекта липидного бислоя сарколеммы повышается её проницаемость, особенно при мышечном напряжении; свой вклад вносит и цитотоксичность макрофагов, лизирующих сарколемму после физических нагрузок (на мембране дистрофически изменённых волокон концентрируются антигены I класса главного комплекса гистосовместимости (HLA), что делает её более уязвимой для Т-клеточно-опосредованной атаки). При этом внутриклеточная КФК выходит в кровь, а внеклеточный кальций устремляется в миоциты. Воспалительный каскад активирует выработку фиброзирующего цитокинового трансформирующего фактора роста (TGF-β1), вызывающего потерю мышечной ткани из-за нарушения процессов регенерации. Предполагается, что регенеративная способность мышечной ткани истощается за счёт дефицита клеток-спутников после непрерывно протекающих циклов дегенерации-регенерации.
Заболевание характеризуется достаточно стереотипным течением, проходя в своём развитии несколько стадий, что схематично представлено на рисунке ниже.
Типичное прогрессирование симптоматики с возрастом при миодистрофии Дюшенна (источник: http://www.prosensa.eu/img/timeline-DMD-patient.png, с изменениями)
Как правило, при рождении у больных миодистрофией Дюшенна не выявляется каких-либо значимых отклонений. В первые месяцы моторное развитие детей вполне нормальное или происходит с незначительным запаздыванием. Первое, на что обращают внимание окружающие, является задержка начала ходьбы: ходить такие дети начинают, как правило, не ранее 18 месяцев. Обычно к 4-5 годам становится отчётливо заметен дефект походки: она приобретает характер «утиной», больной широко расставляет ноги, передвигается на цыпочках, развивается поясничный гиперлордоз (т.н. «генеральская» походка).
Миодистрофия Дюшенна: характерная поза при стоянии, родные братья 4 и 6 лет (источник: http://www.jaaos.org/content/10/2/138/F2/graphic-7.medium.gif)
ВИДЕО: «ГЕНЕРАЛЬСКАЯ» ПОХОДКА
Переваливающаяся походка обусловлена нарастающей слабостью большой и средней ягодичных мышц, лишающей больных возможности поддерживать положение тела при переносе веса на одну ногу. Гиперлордоз обусловлен слабостью разгибателей бёдер, приводящей к наклону таза вперёд и компенсаторному переразгибанию в поясничном отделе позвоночника. Из-за того, что поддерживать тело в вертикальном положении легче при эквинусной установке стопы, ребёнок начинает ходить на цыпочках, хотя к тому времени ещё не развивается клинически значимых контрактур ахилловых сухожилий.
Схематическое изображение групп мышц, вовлекаемых в процесс при миодистрофии Дюшенна (источник: http://mda.org/sites/default/files/bmd_dmd_1.jpg)
Со временем изменения походки усугубляются: появляются трудности при подъёме по лестнице, беге, ребёнок начинает падать (без спотыканий или отключений) из-за того, что «стопы как бы уходят из-под него». Типичные жалобы родителей — это ходьба детей на пальцах и частые падения.
ВИДЕО: МОТОРНЫЕ НАВЫКИ МАЛЬЧИКА 3 ЛЕТ
Задержка темпов двигательного развития часто обнаруживается ретроспективно при анализе анамнестических сведений. Ранние симптомы подкрадываются незаметно. Недостаточную, по сравнению со сверстниками, подвижность ребенка, его двигательную пассивность часто относят к особенностям темперамента и характера Присоединяются затруднения при вставании из положения сидя, больной вынужден прибегать к приёму Говерса. Пока больные сохраняют способность ходить, деформации выражены у них в минимальной степени – возможно лишь уплотнение ахилловых сухожилий и подвздошно-поясничных мышц, а также лёгкий сколиоз. За счёт поражения мышц тазового пояса затруднён и переход из горизонтального положения в вертикальное. Двигательные функции выглядят относительно стабильными между 3 и 6 годами жизни. Вовлечение мышц плечевого пояса на ранних стадиях обычно не выражено, разве только при проверке мышечной силы выявляется слабость проксимальных отделов рук. Однако оно, наряду с дистальными атрофиями конечностей и сколиозом, начинает стремительно прогрессировать после того, как больной пересаживается в инвалидное кресло. Этот переломный момент в течении заболевания обычно наступает между 7 и 13 годами жизни, и если к 13 годам больной сохраняет способность к ходьбе, следует предположить у него более мягкую форму Х-сцепленной прогрессирующей миодистрофии – миодистрофию Беккера.
Миодистрофия Дюшенна: характерный внешний вид колясочного больного (источник: http://babylab2.wikispaces.com/file/view/musculardys.jpg/219090918/musculardys.jpg)
Поражение мышц плечевого пояса приводит к ограничению движений в плечевых суставах. Больные не могут поднять руки выше горизонтального уровня, в то время как объем движений в локтевых и лучезапястных суставах и сила мышц длительное время остаются сохранными. При попытке поднять больного под мышки его голова как бы проваливается в плечи – симптом «свободных надплечий». Лопатки отстают от туловища — симптом «крыловидных лопаток».
Миодистрофия Дюшенна: симптом свободных надплечий (источник: http://www.ordodeus.ru/Miopatiya_5.jpg)
Миодистрофия Дюшенна: симптом крыловидных лопаток (источник: http://www.ordodeus.ru/Miopatiya_4.jpg)
Миодистрофия Дюшенна: атрофия мышц лопатки и плечевого пояса (источник: Suresh Chandran C.J. «Hidden mounts» in Duchenne muscular dystrophy // Neurol. India, 2008. – Vol.56. – N.3. – P.394)
Кроме нарастающей симметричной мышечной слабости в строго определённых группах мышц с последующей их, также симметричной, атрофией (кстати, нередко атрофии мышц маскируются хорошо развитой подкожной жировой клетчаткой), для миодистрофии Дюшенна характерны следующие симптомы:
- Умственная отсталость. Некоторая задержка развития психических функций отмечается уже в первые годы жизни. Дети малоэмоциональны. Речь развивается с запозданием и носит примитивный характер. Отсутствует абстрактное мышление. Навыки опрятности и самообслуживания формируются с трудом. Умственная отсталость различной степени: от пограничной интеллектуальной недостаточности до выраженной олигофрении развивается у 30% больных с миодистрофией Дюшенна в связи с дефицитом церебральных изоформ дистрофина — аподистрофинов. Тяжесть олигофрении и нарушений высших когнитивных функций не коррелирует с выраженностью мышечного дефекта и стадией миодистрофического процесса. К экзогенным факторам, усугубляющим проявления умственной отсталости, относят развивающуюся социальную дезадаптацию вследствие невозможности из-за двигательного дефекта полноценного участия детей в детских коллективах (сад, школа), влияние неблагоприятных перинатальных причин и, возможно, дисгенезий головного мозга (при КТ и МРТ изредка обнаруживают признаки церебральной атрофии). У детей, страдающих миодистрофией Дюшенна, чаще, чем в среднем в популяции, выявляются расстройства аутистического спектра.
- Снижение, а позднее и утрата сухожильных рефлексов. В первую очередь снижаются коленные, затем остальные рефлексы. Исключением являются ахилловы рефлексы, которые могут сохраняться вплоть до поздних стадий болезни.
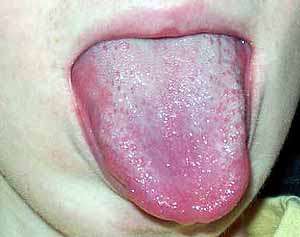
- Псевдогипертрофия некоторых групп мышц на фоне атрофического процесса. Наиболее характерны псевдогипертрофии икроножных мышц, хотя они могут развиваться и в других мышечных группах (ягодичных, дельтовидных мышцах, мышцах живота и языка). Псевдогипертрофия икроножных мышц создает обманчивое впечатление о сохранности мышечной силы и даже радует родителей. Атрофия мышц может быть локальной и генерализованной. Локальная выявляется лишь на ранних стадиях заболевания, по мере прогрессирования патологического процесса атрофия приобретает генерализованный характер вплоть до мышечной кахексии. Атрофированные мышцы истончены, дряблые при пальпации.
Миодистрофия Дюшенна: макроглоссия за счёт псевдогипертрофии мышц языка (источник: http://neuromuscular.wustl.edu/pics/people/patients/tonguehypertdmdsm.jpg)
- Изменения внешности. При слабости и атрофии мышц лица отмечается отсутствие морщин на лбу (симптом «полированного лба»). Наблюдается гипомимия: больные не могут плотно зажмурить глаза, надуть щеки, вытянуть губы в трубочку и т. д. В некоторых случаях вследствие замещения губных мышц соединительной и жировой тканью губы утолщаются (напоминают «губы тапира»).
Миодистрофия Дюшенна: характерный внешний вид больного с фотографии, выполненной самим Дюшенном (источник: http://www.artandmedicine.com/biblio/images/duchenne/DuchenneAlbum16.jpg)
- Эндокринные расстройства. Прежде всего, к ним относится ожирение. Нейроэндокринные нарушения встречаются почти у половины пациентов. Чаще других наблюдаются синдром Иценко–Кушинга, адипозогенитальная дистрофия Бабинского–Фрёлиха. Встречается низкорослость.
- Изменения костной системы. Поясничный гиперлордоз, кифосколиоз грудного отдела позвоночника, деформации грудной клетки и стоп, диффузный остеопороз (за счёт малоподвижного образа жизни, приёма глюкокортикостероидов). На рентгенограммах обнаруживают сужение костномозгового канала, истончение коркового слоя диафизов длинных трубчатых костей.
- Сердечно-сосудистые расстройства. Клинически проявляются лабильностью пульса, артериального давления, иногда глухостью тонов и расширением границ сердца. На ЭКГ регистрируются изменения миокарда (блокада ножек пучка Гиса и др.). Сердечно-сосудистая система вовлекается в патологический процесс достаточно часто и рано. Около 73% больных имеют различные проявления кардиальной патологии. Причиной сердечно-сосудистой патологии является генетически детерминированный недостаток дистрофина в кардиомиоцитах. Отсутствие четкой корреляции между тяжестью поражения скелетных мышц и наличием выраженной кардиомиопатии у пациентов с миодистрофией Дюшенна предопределило необходимость обратить особое внимание на исследование маркеров вовлечения сердечной мышцы в патологический процесс. Оказалось, что делеции гена дистрофина являются не единственной причиной поражения мышечной ткани у пациентов с прогрессирующей мышечной дистрофии Дюшенна. В настоящее время ученые выделяют три основных причины: дефицит дистрофина, обусловленный генетическим дефектом; дефицит дистрофин-ассоциированного гликопротеина (молекулярная масса 50 кДа) или других дистрофинассоциированных белков, наличие особого генетического варианта строения ангиотензин-конвертирующего фермента. Сердечная мышца может поражаться как вследствие всех трех причин, так и их комбинаций. Например, дефицит дистрофин-ассоциированного гликопротеина может наблюдаться исключительно в кардиомиоцитах, в то время как в склетной мышечной ткани его содержание будет нормальным. Обнаружение дефицита дистрофин-ассоциированных белков при исследовании биоптата сердечной мышцы является предиктором развития тяжелой кардиомиопатии. Особое внимание последние годы уделяется строению ангиотензин-конвертирующего фермента: предполагается, с ним связана выраженность кардиомиопатии. Выявление маркеров вовлечения сердечной мышцы в патологический процесс позволяет ответить на исключительно важный практический вопрос – почему кардиомиопатия может наблюдаться у пациентов с легкими вариантами поражения скелетных мышц, а также возможность дебюта заболевания с кардиомиопатии. Как правило, начальные проявления кардиальной патологии у больных возникают уже в раннем возрасте и прогрессируют с годами. В отдельных случаях, у детей 3-5 лет, в клинической картине заболевания могут преобладать кардиальные симптомы, а симптомы мышечной дистрофии могут быть маскированными. Низкая физическая активность пациентов с прогрессирующей мышечной дистрофии Дюшенна, относительно быстрая утрата способности к самостоятельной ходьбе, снижающая нагрузку на миокард, а также недостаточная нацеленность родителей на выявление кардиальных жалоб (основное внимание обращается прежде всего на двигательные нарушения), приводят к тому, что менее 15% детей до 14 лет, имеющих поражение мышцы сердца, активно обращаются к кардиологу. В то время как по данным целевых исследований у детей, не предъявляющих кардиальных жалоб, поражение мышцы сердца выявляется у 25% в возрасте до 6 лет и у 59% в возрасте от 6 до 10 лет. В дальнейшем этот процент снижается, поскольку поражение сердца прогрессирует и дети начинают предъявлять кардиальные жалобы. Патогенез поражения мышцы сердца при миодистрофии Дюшенна в настоящее время представляется следующим образом: прогрессирующая атрофия кардиомиоцитов и замещение их фиброзной тканью приводят к истончению миокарда (особенно левого желудочка, на который приходится основная гемодинамическая нагрузка), а также к снижению его способности к систолическому сокращению и диастолическому расслаблению. Выраженный фиброз в области задних папиллярных мышц ведет к пролабированию створок митрального клапана в полость левого предсердия (пролапс митрального клапана) с или без наличия митральной регургитации. Частота выявления пролапса митрального клапана у пациентов с прогрессирующей мышечной дистрофии Дюшенна составляет от 25 до 55%. Увеличение размеров левого предсердия как правило вторично, вследствие митральной регургитации или снижения сократительной способности левого желудочка. Нарушения ритма сердца и проводимости возникают вследствие прогрессирующего фиброза проводящей системы сердца. Обычно поражение сердечной мышцы впервые диагностируется между 6 и 7 годами. С возрастом частота выявления кардиальных симптомов возрастает, и к 20 годам патология сердечно- сосудистой системы встречается у 95% больных. Наиболее частыми нарушениями, наблюдавшимися у 54% пациентов, были: тахикардия, аритмии и сердечная недостаточность. Особенно выражены данные симптомы в конечных стадиях заболевания. Учитывая особенности двигательной активности пациентов с миодистрофией Дюшенна (а также с миодистрофией Беккера), отсутствие кардиальных жалоб, весьма малую физическую активность, часто обездвиженность на поздних этапах заболевания, в 1993 году был предложен и введен в медицинскую практику новый диагностический термин – латентная сердечная недостаточность.
- Патология системы органов дыхания. Слабость дыхательной мускулатуры и диафрагмы обусловливает уменьшение жизненной ёмкости лёгких до 20% от нормы, что приводит к эпизодам ночной гиповентиляции. Дети часто встают со страхом, связанным с ощущением удушья, и боятся спать. Существенный вклад в летальность вносит дыхательная недостаточность, которая провоцируется интеркуррентными инфекциями или аспирацией.
Болезнь может протекать по одному из нескольких клинических вариантов, краткое описание которых приведено в таблице.
|
|
|
|
|
|
|
|
2-5 |
Теряет способность ходить в 10-12 лет. Генерализованная мышечная слабость, затем сколиоз, контрактуры голеностопных, коленных и других суставов | Масса тела снижена. Психическое развитие в норме; кардиомиопатия обнаруживается после 8-10 лет |
30% |
|
|
2-5 |
Теряет способность ходить в 10 лет или ранее. Генерализованная мышечная слабость, затем сколиоз, контрактуры голеностопных и других суставов | Ожирение (лунообразное лицо, отложение жира по женскому типу). Kардиомиопатия обнаруживается после 10 лет |
22% |
|
|
1-2-й год жизни |
Теряет способность ходить до 10 лет, иногда в 6,5-7 лет. Ранние множественные контрактуры. Быстрое прогрессирование | Масса тела снижена или в норме. Задержка психического развития. Kардиомиопатия обнаруживается в 7-10 лет |
13% |
|
|
2-6 |
В 6,5-7 лет обнаруживается кардиомиопатия при небольших проявлениях мышечной слабости (затруднения при подъеме по лестнице). Относительно медленное прогрессирование | Масса тела снижена или в норме. Психическое развитие в норме |
7% |
|
|
1-6 |
Теряет способность ходить в 10-12 лет или ранее. Генерализованная мышечная слабость | Различные сочетания |
28% |
Диагностика миодистрофии Дюшенна основывается на анамнезе (в т.ч. семейном), клинической картине заболевания и ряде дополнительных методов исследования. К последним относятся:
Исследование КФК сыворотки крови. В здоровых клетках КФК катализирует синтез креатина и АТФ из фосфокреатина и АДФ. При миодистрофии Дюшенна (и, в меньшей степени, Беккера) физические нагрузки приводят к массивному высвобождению КФК, инициирующему воспалительную реакцию. Поэтому уровень КФК сыворотки крови значительно повышен при миодистрофии Дюшенна и, в меньшей степени – Беккера. Отклонения уровня КФК сыворотки при некоторых дистрофинопатиях приведены в таблице.
|
|
Фенотип |
% случаев |
Концентрации КФК |
| Мужчины | Миодистрофия Дюшенна |
100 |
В 10 раз и более выше нормы |
| Миодистрофия Беккера |
100 |
В 5 раз и более выше нормы |
|
| Дюшенн-ассоциированная дилатационная кардиомиопатия |
В большинстве случаев |
Повышена |
|
| Женщины-носительницы | Миодистрофия Дюшенна |
~50 |
В 2-10 раз выше нормы |
| Миодистрофия Беккера |
~30 |
В 2-10 раз выше нормы |
С возрастом концентрация КФК постепенно падает, по мере резорбции дистрофических мышечных волокон.
ЭНМГ. Позволяет отдифференцировать первично-мышечное поражение от нейрогенного. При первом выявляются быстро рекрутируемые, короткие по длительности полифазные низкоамплитудные потенциалы двигательных единиц. По мере прогрессирования заболевания интерференционный паттерн ЭНМГ становится редуцированным за счёт снижения рекрутирования, и в конце концов регистрируется биоэлектрическое «молчание» мышцы. Данные ЭНМГ не являются специфичными и одинаковы при любой форме первично-мышечного поражения. Поэтому на практике ЭНМГ в диагностике миодистрофии Дюшенна используется достаточно редко.
Биопсия скелетных мышц. Производится для гистологического исследования биоптата, а также проведения иммуногистохимических тестов и вестерн-блоттинга. Гистологически на ранних стадиях заболевания выявляются неспецифические дистрофические изменения – вариабельность размеров волокон, очаги некроза и регенерации, гиалинизация; на поздних стадиях – отложения жира и разрастание соединительной ткани.
Миодистрофия Дюшенна, срез биоптата мышцы, окрашенный гематоксилин-эозином. Отмечается выраженный фиброз эндо- и перимизия, выраженная вариабельность диаметра мышечных волокон за счёт наличия атрофированных и гипетрофированных волокон (источник: http://img.medscape.com/pi/emed/ckb/pathology/1603817-1607648-1869808-1870086.jpg)
Миодистрофия Дюшенна, срез биоптата мышцы, окрашенный гематоксилин-эозином. Два мышечных волокна, занимающих бóльшую часть среза,на самом деле представляют собой единое гипертрофированное волокно, расщеплённое новообразованной соединительнотканной перемычкой (источник: http://img.medscape.com/pi/emed/ckb/pathology/1603817-1607648-1869808-1870088.jpg)
Миодистрофия Дюшенна, срез биоптата мышцы, окрашенный гематоксилин-эозином. Видно некротизированное мышечное волокно с бледной цитоплазмой в стадии миофагоцитоза. Кроме того, на срезе видны следующие признаки миодистрофического процесса: увеличение числа ядер мышечных волокон, аномально высокая вариабельность диаметра мышечных волокон, два гиалинизированных мышечных волокна (сразу под некротизированным) и выраженный фиброз (источник: http://img.medscape.com/pi/emed/ckb/pathology/1603817-1607648-1869808-1870089.jpg)
Миодистрофия Дюшенна, срез биоптата мышцы, окрашенный гематоксилин-эозином. Некоторые волокна выглядят крупными, более красноватыми и «стекловидными». Они называются «гиалинизированными» или «тёмными» и представляют собой избыточно сокращённые мышечные волокна. На срезе также видна аномальная вариабельность диаметра волокон, локальный некроз мышечных волокон, умеренное увеличение числа ядер мышечных волокон и выраженный фиброз эндо- и перимизия. Следует заметить, что гиалинизированные волокна могут встречаться как артефакты (источник: http://img.medscape.com/pi/emed/ckb/pathology/1603817-1607648-1869808-1870089.jpg)
Срез биоптата икроножной мышцы больного, погибшего от миодистрофии Дюшенна. Видно массивное замещение мышечной ткани жировыми клетками (источник: http://upload.wikimedia.org/wikipedia/commons/thumb/4/49/Duchenne-muscular-dystrophy.jpg/800px-Duchenne-muscular-dystrophy.jpg)
Чтобы повысить специфичность диагностики, используется иммуногистохимическое исследование с определением процентного содержания дистрофина в мышечных волокнах, полученных при биопсии мышц, путём прокрашивания антидистрофиновыми антителами к С-концу, срединному участку и N-концу молекулы дистрофина. При окрашивании этим методом интактной мышечной ткани выявляется равномерное распределение красителя по периферии мышечных волокон, соответствующее субсарколеммной локализации дистрофина.
Ииммуногистохимический анализ биоптата здоровой мышцы на дистрофин. На срезе, прокрашенном антителами к дистрофину, видно равномерное субсарколеммальное коричневое окрашивание мембраны всех мышечных волокон (источник: http://img.medscape.com/pi/emed/ckb/pathology/1603817-1607648-1869808-1870093.jpg)
При миодистрофии Дюшенна субсарколеммальное окрашивание не выявляется при использовании антител к С-, N-концам и срединному участку (при миодистрофии Беккера – только при использовании антител к N-концу).
Миодистрофия Дюшенна, иммуногистохимический анализ биоптата мышцы на дистрофин. Ни одно из мышечных волокон (за исключением единственного, отмеченного на рисунке стрелкой) не прокрашивается антителами к дистрофину. Идентичный результат получается при окрашивании антителами к С-концу, N-концу и срединному участку дистрофина (источник: http://img.medscape.com/pi/emed/ckb/pathology/1603817-1607648-1869808-1870095.jpg)
В редких случаях единичные волокна могут сохранять окрашивание при иммуногистохимическом исследовании (как раз такое волокно отмечено стрелкой на предыдущем рисунке). Это происходит благодаря второй мутации в гене дистрофина, восстанавливающей рамку считывания и оставляющей таким образом возможность синтеза дистрофина в данном волокне. Эти наблюдения открывают перспективы для разработки одного из потенциальных направлений лечения миодистрофий.
Возможно также иммуногистохимическое исследование биоптата мышцы на утрофин – аутосомный гомолог дистрофина, который синтезируется в постнатальном периоде главным образом в нервно-мышечных соединениях. При дистрофинопатиях экспрессия утрофина повышена и он может определяться в сарколемме.
Иммуногистохимический анализ биоптата мышцы на утрофин в норме (А) и при миодистрофии Дюшенна (В). На рисунке А представлена картина экспрессии утрофина в норме у детей и взрослых: волокна не окрашиваются, утрофин определяется лишь в стенке сосудов. На рисунке В показана активация экспресии утрофина при дистрофинопатии:сарколеммы интенсивно окрашиваются, что может быть отражением компенсаторного синтеза утрофина в условиях дефицита дистрофина. Участки просветления в цитоплазме мышечных волокон соответствуют артефактам в виде микрокристаллов льда (источник: http://img.medscape.com/pi/emed/ckb/pathology/1603817-1607648-1869808-1870172.jpg)
Вестерн-блоттинг – современный высокочувствительный аналитический метод, используемый для определения специфичных белков в сложных смесях с помощью антител. Метод основан на комбинации гель-электрофореза и иммунохимической реакции «антиген-антитело». С помощью гель-электрофореза белки разделяются в полиакриламидном геле. Далее белки переносят на нитроцеллюлозную или PVDF-мембрану. Затем их детектируют с использованием антител методом «сэндвича»: сначала белки связываются с первичными (моно- или поликлональными) антителами, которые в свою очередь связываются со вторичными антителами, конъюгированными с ферментами (пероксидазой хрена или щелочной фосфатазой). Визуализация исследуемого белка достигается путем проведения соответствующей биохимической реакции с образованием продукта, который определяется колориметрическим, хемилюминесцентным, флюоресцентным методами детекции. Количество белка может быть оценено с помощью денситометрии. Высокая степень разрешения достигается за счет электрофоретического разделения белков и специфичности моноклональных антител. В оптимально отработанных условиях вестерн-блоттингом можно обнаруживать антиген в количествах менее 1нг. Метод применяется для верификации положительных результатов иммуногистохимического исследования. При миодистрофии Дюшенна количество дистрофина составляет 0-5% от нормы.
Генетический анализ крови. Это в настоящее время самый точный метод диагностики миодистрофии Дюшенна (и других дистрофинопатий), который благодаря своей высокой информативности зачастую является единственным дополнительным методом диагностики этого заболевания за рубежом. Это обусловлено тем, что дистрофинопатии развиваются исключительно при мутациях одного гена – гена DYS. Для проведения исследования необходимо 2 мл венозной крови. Исследование проводится методами поиска делеций/дупликаций и анализа (сканирования) мутаций, является достаточно трудоёмким и финансово затратным.
Возможна пренатальная диагностика миодистрофии Дюшенна методами молекулярно-генетического исследования (анализ ДНК клеток плода на характерные мутации), биопсии мышц плода и преимплантационной генодиагностики.
Лечение миодистрофии Дюшенна к настоящему времени не разработано. Существуют лишь способы несколько замедлить прогрессирование заболевания и улучшить качество жизни пациентов.
К медикаментозной терапии, влияющей на течение заболевания, относятся:
Приём глюкокортикостероидов. Доказано, что если начать глюкокортикостероидную пероральную терапию в то время, когда становится заметной остановка физического развития ребёнка (как правило, в возрасте 4-6 лет), происходит заметная задержка прогрессирования утраты мышечной массы, нарастание мышечной силы и улучшение функционального состояния пациента. Если же глюкокортикостероиды назначить, когда ребёнок уже утратил способность к передвижению, эффективность их близка к нулю. При этом объяснить действие этой группы препаратов лишь иммуносупрессией невозможно, т.к. назначение иммунодепрессанта азатиоприна больным с миодистрофией Дюшенна, как показали исследования, не сопровождается каким-либо лечебным эффектом. Оптимальным режимом терапии преднизолоном считается ежедневный приём per os в дозе 0,75 мг/кг/сут (но не более 40 мг/сут) до появления значимых побочных эффектов, после чего производится постепенное снижение дозы до 0,5 мг/кг/сут, а в случае сохранения серьёзных побочных эффектов – до 0,3 мг/кг/сут. Альтернативной схемой является приём в тех же дозах через день или «интермиттирующий» приём (10 дней приёма, 10-20 дней перерыв). Лицам, у которых на фоне ежедневного приёма преднизолона развивается ожирение и поведенческие расстройства, можно рекомендовать переход на приём в дозе 5 мг/кг два дня в неделю (например, по пятницам и субботам). Положительный эффект (нарастание мышечной силы) отмечается уже к 10-му дню от начала лечения. В европейских и некоторых других странах используется синтетическое прозводное преднизолона – дефлазакорт (производится в Великобритании, Испании, Индии, Бразилии, Панаме и Гондурасе). Показано, что он в меньшей степени вызывает побочные эффекты, особенно что касается ожирения, однако, при его применении чаще развивается бессимптомная катаракта. Дозировка дефлазакорта – 0,9 мг/кг/сут (но не более 39 мг/сут). Многие специалисты рекомендуют оставлять пациента на поддерживающей дозе глюкокортикостероидов и после того, как он пересел в инвалидную коляску: это позволяет дольше сохранить силу в руках, замедлить прогрессирование кардиореспираторных нарушений и развитие сколиотической деформации позвоночника. К основным побочным эффектам длительной глюкокортикостероидной терапии относятся: поведенческие расстройства, задержка роста, ожирение, остеопороз, нарушение толерантности к глюкозе, иммуносупрессия, надпочечниковая недостаточность, диспепсия, пептические язвы, катаракта, кожные проявления. С большинством из них можно бороться, не снижая дозы препарата.
Приём агонистов β2-адренорецепторов. В нескольких рандомизированных исследованиях показан положительный эффект β2-агонистов на мышечную силу, однако, на течение заболевания они влияния не оказывают. Эти вещества используются для лечения бронхиальной астмы и включают такие препараты, как сальбутамол, формотерол и др.
Приём других лекарственных препаратов. Возможно, некоторый положительный эффект на течение заболевания оказывают аминокислоты, карнитин, коэнзим-Q10, рыбий жир, экстракт зелёного чая и витамин Е.
Приём кардиотропных препаратов. Около 2/3 больных миодистрофией Дюшенна испытывают те или иные кардиологические проблемы и, пожалуй, самая существенная из них – развитие дилатационной кардиомиопатии. При появлении у больного её эхокардиографических (или клинических) признаков назначаются ингибиторы АПФ; если через 3 месяца лечения улучшения не происходит, добавляют β-адреноблокаторы (карведилол или метопролол). В случае прогруссирующего течения присоединяют диуретики, препараты наперстянки.
Немедикаментозные методы. Поощряется посильная физическая активность: малоподвижный образ жизни ускоряет прогрессирование мышечной дисфункции. Показаны также физиотерапевтические процедуры и занятия с логопедом. Используется также искусственная вентиляция лёгких, различные ортопедические приспособления, моторизованные инвалидные коляски.
Несмотря на все эти мероприятия, прогноз заболевания в целом неблагоприятный: большинство больных погибают в возрасте около 25 лет, чаще всего от респираторных расстройств.
В настоящее время в мире проводятся исследования, направленные на разработку новых перспективных методов лечения миодистрофии Дюшенна.
Генная терапия. Несмотря на очевидные успехи в исследованиях структуры гена дистрофина, его продуктов, и в выяснении биомеханизмов заболевания, реальных успехов в генотерапии миодистрофии Дюшенна пока не достигнуто. Причиной этого являются, по-видимому, не только гигантские размеры гена и его матричной РНК (мРНК), но и, главным образом, отсутствие эффективных средств доставки гена в мышцы, а также развитие иммунного ответа на введение гена. Считается, что достижение терапевтического эффекта возможно при успешной трансфекции не менее 20%, а по последним данным даже 40% всех мышечных волокон не только скелетной мускулатуры, но так же мышц сердца и диафрагмы. При этом основными критериями эффективности трансфекции являются: появление дистрофин-положительных мышечных волокон, нормализация уровня биохимических маркеров миодистрофии Дюшенна, изменения физиологических параметров (силы мышц и др.).
В активно разрабатываемых в настоящее время генотерапевтических подходах можно выделить несколько направлений: 1) коррекция дефекта путем введения нормальных копий комплементарной ДНК (кДНК) гена дистрофина в составе рекомбинантных вирусных частиц или посредством невирусных способов доставки; 2) коррекция мутаций на уровне геномной копии гена или на его первичном РНК-транскрипте; 3) активация в мышечных волокнах и клетках репрессированного в ходе онтогенеза аутосомного гомолога гена дистрофина – гена утрофина.
Трансфекция мышечных волокон с использованием вирусных векторов. Эксперименты проводились как с ретровирусными векторами, несущими укороченную кДНК «мини»-гена DYS, так и с аденовирусными векторами, способными нести полноразмерную кДНК этого гена. В экспериментах на мышах удалось продемонстрировать достаточно эффективную и долговременную трансфекцию скелетных и сердечной мышц после внутривенного введения рекомбинантного аденовируса с кДНК гена дистрофина. Была так же продемонстрирована принципиальная возможность трансфекции и синтеза дистрофина в мышцах диафрагмы mdx-мышей (лабораторная популяция мышей с дефектами гена DYS) с использованием полноразмерной кДНК гена дистрофина человека. Кроме нормализации синтеза дистрофина, удалось показать, что сверхэкспрессия этого гена (уровень белка в 50 раз выше нормы) не оказывает вредных побочных эффектов. Вместе с тем, использование вирусных носителей, особенно в экспериментах in vivo, наталкивается на существенные методические трудности. К ним относятся – недостаточная пакующая способность у ретровирусов, необходимость наличия клеток-хелперов. Наибольшим серьезным препятствием к использованию вирусных векторов для доставки генетических конструкций является выраженный иммунный ответ на вирусные антигены. Несмотря на огромный объем работ по модификации генома вируса носителя, сокращения размера вирусного генома до минимально возможного размера, иммунный ответ тем не менее сохраняется и делает бессмысленными повторные введения генных конструкций. Тем не менее работы по совершенствованию вирусных способов доставки не прекращаются. Наиболее перспективно введение гена дистрофина новорожденным мышам. Было продемонстрировано, что в результате трансфекции мышат аденовирусным вектором и компактизацией ДНК полилизином pK8, экспрессия дистрофина регистрировалась в течении почти 1 года.
Невирусные способы доставки кДНК гена дистрофина. Невирусные способы доставки включают баллистическую трансфекцию, методы электропорации (электрошока), введение генетических конструкций в составе липосом или упакованных с помощью олигопептидов, молекулярных коньюгатов, полимерных носителей. Эти носители в значительной мере лишены недостатков присущих вирусным векторам, однако, способность к трансформации у большинства из них ниже, чем у вирусных векторов. Первые эксперименты по доставке «голой» плазмидной ДНК с кДНК гена дистрофина человека показали возможность трансфекции и появление дистрофин-положительных мышечных волокон у mdx-мышей.
Наиболее продвинутыми на сегодняшний день являются исследования по доставке гена дистрофина методом электропорации или с носителем на основе полимерной формы декстрана. В последнем случае для доставки гена дистрофина использовали декстран, обеспечивающий самособирающийся ДНК полимерный комплекс. Отсутствие токсичности и иммунного ответа, диссеминация по различным группам мышц и достаточно длительная (более двух месяцев) экспрессия показали перспективность данной системы доставки для проведения клинических испытаний.
Еще более обнадёживающие результаты получены в экспериментах на мышах, крысах, кроликах и обезьянах по доставке генетических конструкций в мышцы с помощью электропорации. Восьмикратный электрический импульс (200 V/cm2, 20 мсек, 17 Гц), через 30 секунд после введения плазмид с геном β-галактозидазы LacZ приводил к синтезу β-галактозидазы в 76% мышечных волокон, а с использованием электрошока только в 8%.
Генная терапия на уровне первичного транскрипта гена дистрофина. Из этих методов особое внимание привлекает техника направленной утраты экзона, несущего мутантный стоп-кодон, разработанная в лаборатории Джорджа Диксона в Великобритании. Работа выполнялась in vitro на миобластах mdx-мышей mdx с нонсенс-мутацией в 23 экзоне гена дистрофина. В условиях in vitro было показано что уже через 6 часов после трансфекции специфическими олигонуклеотидами (антисенс-олигонуклеотидами) удаление мутантного 23 экзона происходило в 50% мРНК и в 100% мРНК через 24 часа. Перспективность данного подхода заключается в том, что миобласты начинают синтезировать полноразмерный белок дистрофина, хотя и дефектный по одному функционально несущественному экзону. Будучи пересаженными больному модифицированные миобласты смогут восстанавливать функцию и предотвращать гибель пораженных мышечных волокон.
Учитывая оригинальность метода и его большие перспективы, остановимся на кратком разъяснении его сути. Напомним, что белок дистрофин выполняет «якорную» функцию, соединяя белки «скелета» мышечного волокна с соединительнотканными структурами, окружающими мышечное волокно. Он служим «амортизатором», предохраняющим мышечное волокон от повреждения в процессе сокращения и расслабления мышцы. Схематически можно представить дистрофин в виде верёвки, соединяющей якорь и лодку. Якорь может выполнять свою функцию только если соединён с лодкой верёвкой.
Схематическое представление «якорной» функции дистрофина (источник: http://www.humgen.nl)
Ген, кодирующий дистрофин (ген DYS), состоит из 79 экзонов (информативно значимых участков ДНК) и имеет не менее 4 промоторов. Экзоны располагаются по типу «последовательного паззла», конец каждого совпадает с концом последующего, как показано на рисунке ниже.
Схематическое представление расположения экзонов в гене дистрофина (источник: http://www.humgen.nl)
Самой распространённой мутацией гена DYS при миодистрофии Дюшенна является делеция – когда из гена исчезают один или несколько экзонов. В приведённом ниже примере это экзоны 48, 49 и 50.
Схематическое представление делеции 48, 49 и 50-го экзонов в гене дистрофина (источник: http://www.humgen.nl)
При ближайшем рассмотрении участка делеции становится видно, что 47-й экзон не подходит к 51-му.
Схематическое представление делеции 48, 49 и 50-го экзонов в гене дистрофина при ближайшем рассмотрении (источник: http://www.humgen.nl)
Из-за этого несовпадения считывание генетического кода прерывается, останавливаясь на 47-м экзоне, в результате чего синтезируется лишь часть молекулы дистрофина, не способная выполнять свою якорную функцию.
Часть верёвки, привязанная к лодке, отсутствует, якорь отрывается, лодка уплывает (источник: http://www.humgen.nl)
Возможен вариант, когда делеция не приводит к остановке считывания генетического кода.
Схематическое представление делеции 48, 49, 50 и 51-го экзонов в гене дистрофина (источник: http://www.humgen.nl)
При ближайшем рассмотрении участка делеции становится видно, что 47-й экзон подходит к 52-му.
Схематическое представление делеции 48, 49, 50 и 51-го экзонов в гене дистрофина при ближайшем рассмотрении (источник: http://www.humgen.nl)
Здесь, в результате длелции, отсутствуют 48-51-й экзоны. Тем не менее, 52-й экзон подходит к 47-му, генетический код не прерывается, матрица оказывается читабельной и синтез белка остаётся возможным даже после участка, на котором произошла мутация. Теперь получается, что и начальный и конечный участки молекулы дистрофина сохранны, только он стал короче за счёт утраты той части, которая была закодирована в экзонах 48-51. Иными словами, функция дистрофина сохранена. Верёвка стала короче, но лодка осталась соединена с якорем и удерживается им на месте.
Часть верёвки, привязанная к лодке, и часть, привязанная к якорю, сохранились, лодка удерживается на месте (источник: http://www.humgen.nl)
Такие мутации, не прерывающие генетический код, характерны для миодистрофии Беккера, именно поэтому это заболевание протекает мягче. Целью терапии пропуском экзонов является перевод течения миодистрофии Дюшенна в течение, характерное для миодистрофии Беккера.
Пропуск экзонов осуществляется с помощью т.н. антисенс-олигонуклеотидов (АОН) – синтетических фрагментов модифицированной ДНК, способных покрывать отдельные экзоны. В результате определённый экзон пропускается при считывании генетического кода и синтез белка восстанавливается. Ниже приведён пример пропуска 51-го экзона.
Схематическое представление пропуска экзона при делеции делеции 48, 49 и 50-го экзонов в гене дистрофина. В результате этой делеции соединяются несовместимые экзоны 47 и 51, и считывание генетического кода останавливается. С помощью АОН, специфичного для 51-го экзона, этот экзон «скрывается» и пропускается при считывании кода. Теперь экзон 47 соединён с экзоном 52 – генетический код восстановлен, синтез белка может продолжаться (источник: http://www.humgen.nl)
Несмотря на теоретическую обоснованность метода до внедрения его в клиническую практику пока ещё далеко. В недавно проведённых клинических испытаниях на 12 пациентах с еженедельным подкожным введением АОН, направленного на экзон 51 (PRO051), был показан рост экспрессии дистрофина у 10, а также улучшение функциональных показателей ходьбы через 3 месяца у 8 из них.
Активизация экспрессии утрофина – аутосомного гомолога гена дистрофина. Суть метода заключается в попытке дерепрессии аутосомного гомолога дистрофина — гена утрофина, продукт экспрессии которого мог бы быть способен компенсировать недостаток дистрофина во всех группах мышц. В эмбриогенезе человека приблизительно до семи недель развития дистрофин не экспрессируется и его функцию в мышцах выполняет белок утрофин. В промежутке между седьмой и 19 неделями развития экспрессируются оба белка и после 19 недели происходит замещение мышечного утрофина на дистрофин. После 19 недели эмбрионального развития утрофин обнаруживается только в области нервно-мышечных контактов. Белок утрофин, имея аутосомную локализацию разительно напоминает дистрофин своими N- и С- концевыми доменами, играющими решающую роль в функции дистрофина, тогда как функционально малозначимый домен центрального стержня присутствует в утрофине в сильно укороченном варианте. Уже получены данные свидетельствующие о том, что трансфекция mdx мышей in vivo геном утрофина приводит к экспрессии утрофина в скелетной мускулатуре и диафрагме. Результаты экспериментов указывают на принципиальную возможность коррекции дефектов в мышечных волокнах лишенных дистрофина с помощью утрофина. Основное внимание последних лет в этом направлении сосредоточено на анализе промоторной области гена утрофина, а также механизмов его регуляции. К настоящему времени идентифицирован промотор В гена утрофина, воздействуя на который можно включать и изменять уровень экспрессии этого гена.
Аминогликозиды. Аминогликозидные антибиотики (в частности, гентамицин) показали свою эффективность в угнетении стоп-кодонов (с появлением которых связано около 15% мутаций при миодистрофии Дюшенна) в культуре клеток in vitro. Тем не менее, попытки введения гентамицина в дозах 7,5 мг/кг/сут пациентам не привели к достоверному клиническому эффекту.
Аталурен (PTC124). Пероральный препарат, не относящийся к группе антибиотиков, который стимулирует рибосомальное считывание нонсенс-мутаций (стоп-кодонов) у mdx-мышей. Клинические испытания низких доз (10-20 мг/кг/сут) аталурена на сохранивших способность к ходьбе пациентах с миодистрофией Дюшенна показали улучшение двигательных функций по сравнению с группой плацебо.
Оксандролон. Анаболический стероид, обладающий минимальным андрогенным и вторичным эстрогеноподобным эффектом, малотоксичный для печени, оказывающий мощное стимулирующее действие на синтез миозина в скелетной мускулатуре и тем самым способствующий наращиванию мышечной массы. Многие исследователи рекомендуют краткосрочный курс терапии оксандролоном (не более 20 мг/сут в течение 3 месяцев) до начала преднизолонотерапии – это ускоряет рост и замедляет прогрессирование мышечной слабости.
Пересадка стволовых клеток. Активно изучаемое направление, пока остающееся в рамках клинического эксперимента. Изоляция и трансплантация клеток-спутников (миосателлитоцитов) в экспериментах на mdx-мышах показала многообещающие результаты. То же касается и пересадки мезенхимальных стволовых клеток.
Пересадка миобластов. Её эффективность при миодистрофии Дюшенна не доказана.
Иммунодепрессанты. Попытки применения азатиоприна успехом не увенчались. Имеются данные о некотором улучшении функции у детей, в течение 8 месяцев получавших терапию циклоспорином, однако, из-за возможности развития циклоспорин-индуцируемой миопатии целесообразность этого метода лечения остаётся спорной.
Креатин. Приём креатина моногидрата в дозе 5г/сут не показал статистически достоверного клинического эффекта, несмотря на свою неплохую переносимость и доказанный эффект снижения уровня миостатина, поэтому данный препарат нельзя рекомендовать в качестве обязательного для применения при миодистрофии Дюшенна.
Ингибиторы гистон-деацетилаз. Препараты этой группы (трихостатин А, вальпроевая кислота, фенилбутират) показали свою эффективность на mdx-мышах, стимулируя экспрессию фоллистатина – ингибитора миостатина.
Ингибиторы (антагонисты) миостатина. Миостатин – белок, который подавляет рост и дифференцировку мышечной ткани. Образуется в мышцах животных, затем выделяется в кровь, оказывая свое действие на мышцы за счет связывания с рецепторами ACVR2B (activin type II receptor). В экспериментах на mdx-мышах введение ингибиторов миостатина привело к росту мышечной массы, снижению уровня КФК сыворотки и улучшению гистологической картины. Однако, клинические испытания препарата MYO-029 (стамулумаба) были завершены уже на фазе I/II из-за отсутствия статистически достоверного эффекта. Кроме того, остаётся неясным, выгодно ли долгосрочное лечение мышечной дистрофии с использованием ингибиторов миостатина, поскольку истощение стволовых клеток мышц может ухудшить течение болезни на более поздних стадиях.
Пожалуй, первой научной публикацией, содержащей описание больного с миодистрофией, следует считать работу английского анатома и хирурга Чарлза Белла, изданную в 1830г. (Bell C. The nervous system of the human body: as explained in a series of papers read before the Royal Society of London. – Edinburgh: Adam & Charles Black, 1830), в которой (случай 89) он описал молодого человека 18 лет с прогрессирующей потерей мышечной массы и слабостью, дебютировавшей в 10-летнем возрасте.
В 1834г. описание сходной клинической картины встречается в работе итальянского врача Giovanni Semmola (Джованни Семмолы), а в 1836г. – итальянских врачей Gaetano Conte (Гетано Конте) и L.Gioja (Гойя) (Conte G., Gioja L. Scrofola del sistema muscolare // Annali Clinici dell’Ospedale degli Incurabili di Napoli, 1836. – N.2. – P.66-79). Последние описали двух братьев, у которых заболевание началось в возрасте 8-10 лет и характеризовалось прогрессирующей слабостью и похуданием ног с увеличением объёма икроножных мышц. В последующем у обоих развились контрактуры в коленных и тазобедренных суставах. Старший брат умер от сердечной недостаточности. Сенсорных нарушений и нарушений интеллекта у братьев выявлено не было. К сожалению в работе не были описаны патологические изменения в мышцах, хотя клиническая картина весьма напоминает миодистрофию Дюшенна. В те времена был очень распространён туберкулёз, поэтому многие современники расценили это сообщение как сообщение о туберкулёзном поражении нервной и мышечной систем.
Несколько лет спустя, в 1847г., английский хирург-ортопед Уильям Джон Литтл описал двух братьев, 12 и 14 лет, которые к 11 годам жизни утратили способность ходить, а в 14 лет старший из них умер. На вскрытии оказалось, что увеличенные в объёме икроножные мышцы были в значительной степени замещены жировой тканью. Наблюдения Литтла были опубликованы в 1853г. (Little WJ. On the nature and treatment of the deformities of the human frame: being a course of lectures delivered at the Royal Orthopaedic Hospital in 1843. – London: Longman, Brown, Green & Longmans, 1853. – P.14-16).
Первое подробное клинико-морфологическое описание болезни с точным и феноменальным для того времени определением её причин принадлежит английскому врачу Эдварду Мериону. В 1852г. он опубликовал статью (Meryon E. On granular and fatty degeneration of the voluntary muscles // Med. Chir. Trans., 1852. – Vol.35. – P.73-84), в которой описал семью с 4 детьми – мальчиками, каждый из которых страдал тяжёлым мышечным заболеванием без поражения, как выяснилось на аутопсии, нервной системы. И уже в более поздней своей монографии (Meryon E. Practical and pathological researches on the various forms of paralysis. – London: Churchill, 1864) он предположил, что в основе этого заболевания лежит разрушение сарколеммы, указал на его генетическую природу и избирательное поражение лиц мужского пола. Всего в этих работах Мерион проследил за шестью семьями, в которых болели 14 мальчиков, а 13 девочек были здоровыми.
В 1865г. немецкий психиатр и невролог Вильгельм Гризингер также описал это заболевание (Griesinger W. Über Muskelhypertrophie // Archiv der Heilkunde, Leipzig, 1865. – Bd.6. – S.1-13). В 1879г. английский невролог сэр Уильям Ричард Говерс (Gowers W. R. Pseudo-hypertrophic muscular paralysis. – London, 1879) показал, что болезнь передаётся мальчикам через клинически здоровых матерей.
Тем не менее, мировое признание всё же получили работы французского невролога и электрофизиолога Гийома Дюшенна, хотя в англоязычной литературе иногда фигурирует эпонимический термин «болезнь Мериона». Статьи Дюшенна (Duchenne G.B.A. De l’electrisation localisie et son application à la pathologie et a la thirapeutique. – 2nd ed. – Paris, Bailliere et fils, 1861) (Duchenne G.B.A. Recherches sur la paralysie musculaire pseudohypertrophique ou paralysie myo-sclerosique // Arch.Gen.Med., 1868. – Vol.11. P.5-25, 179-209, 305-21, 421-43,552-88) были опубликованы в 1861 и 1868гг., когда он уже стал известен благодаря работам по электронейромиостимуляции. В них он привёл подробное описание 13 больных, страдавших, по терминологии автора, «мышечным псевдогипертрофическим параличом» (paralysie musculaire pseudo-hypertrophique).